题目内容
13.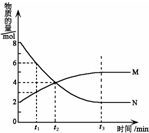 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为2 M?N | |
| B. | t1时N的浓度是M浓度的2倍 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率大于逆反应速率 |
分析 A、根据反应物为物质的量逐渐增多,生成物为物质的量逐渐减少及其物质的量的变化等于计量数之比书写方程式;
B、根据图象得出t1时N的物质的量为6mol.M的物质的量为3mol,结合C=$\frac{n}{V}$判断;
C、根据某一时间反应中各物质的物质的量是否变化判断反应是否达到平衡;
D、根据平衡移动的方向判断正逆反应速率的关系,当反应达到平衡,正逆反应速率相等.
解答 解:A、由图象可知,反应中M的物质的量逐渐增多,N的物质的量逐渐减少,则在反应中N为反应物,M为生成物,图象中,在相等的时间内消耗的N和M的物质的之比为2:1,所以反应方程式应为2N?M,故A错误;
B、t1时,N的物质的量为6mol.M的物质的量为3mol,又同一反应体系体积相同,则根据C=$\frac{n}{V}$,N的浓度是M浓度的2倍,故B正确;
C、由图可知t2时M仍然在增大,N仍然在减小,此时反应继续向正方向移动,反应没有达到平衡,故C错误;
D、由图可知t3时,M、N都不变,则反应达到平衡,正逆反应速率相等,故D错误.
故选B.
点评 本题考查化学反应速率与化学平衡知识,做题时注意从反应物和生成物的物质的量的变化角度,判断反应物和生成物以及反应是否达到平衡,题目难度一般.

练习册系列答案
相关题目
3.如图为番茄电池,下列说法正确的是( )
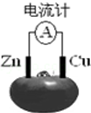

| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
4.化学用语在化学学习中有着重要的作用.下列有关化学用语使用正确的是( )
| A. | CO2的电子式 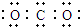 | B. | Cl-的结构示意图 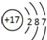 | ||
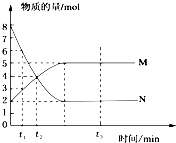
| C. | HCl的电子式 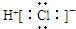 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
1.卤族元素随着原子序数的增大,下列递变规律正确的是( )
| A. | 原子半径逐渐增大 | |
| B. | 单质熔、沸点逐渐降低 | |
| C. | 单质的氧化性逐渐增强 | |
| D. | 最高价氧化物的水化物的酸性逐渐增强 |
18.下列有关化学反应速率和限度的说法中,不正确的是( )
| A. | 实验室用H2O2制取O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水的反应中,增加水的量能加快反应速率 | |
| C. | 对于可逆反应来说,可以通过改变条件改变反应进行的限度 | |
| D. | 当一个可逆反应达到平衡状态时,就是该反应在该条件下所能达到的限度 |
5. 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )| A. | 0~t2内用M表示的平均反应速率是 $\frac{2}{{t}_{2}}$(mol•L-1•min-1) | |
| B. | t1~t2内容器内的压强逐渐减小 | |
| C. | 该反应的方程式为N?2M | |
| D. | t2与t3时刻的混合气体的平均相对分子质量相等 |
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g | |
| D. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
 ,F元素原子的电子排布式1s22s22p63s23p5,
,F元素原子的电子排布式1s22s22p63s23p5, 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)