题目内容
15.某主族元素最外层只有1个电子,则该元素一定是( )| A. | ⅠA族元素 | B. | +7价元素 | C. | 三周期元素 | D. | 金属元素 |
分析 主族元素的最外层电子数=族序数,所以某主族元素最外层只有1个电子,则该元素一定位于周期表中ⅠA族.
解答 解:根据元素周期表结构可知,主族元素的原子序数与族序数关系为:族序数=元素原子的最外层电子数,
则:某主族元素最外层只有1个电子,则该元素一定位于周期表中ⅠA族,属于ⅠA族元素,其化合价为+1价,
故选A.
点评 本题考查了原子结构与元素周期表的关系,题目难度不大,试题侧重基础知识的考查,注意掌握原子结构与元素周期表、元素周期律的关系,明确主族元素的最外层电子数=族序数.

练习册系列答案
相关题目
6.下列物质中,既能发生取代反应,又能发生消去反应,同时催化氧化生成醛的是( )
| A. |  | B. |  | C. | CH3OH | D. |  |
3.如图为番茄电池,下列说法正确的是( )
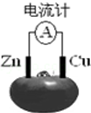

| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
10.按官能团分类,下列物质与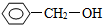 不同类的是( )
不同类的是( )
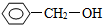 不同类的是( )
不同类的是( )| A. |  | B. | 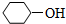 | C. | CH3CH2OH | D. | HOCH3 |
7.下列说法不正确的是( )
| A. | 1mol有机物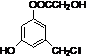 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 | |
| B. | 有机物分子 与银氨溶液作用后仍具有光学活性 与银氨溶液作用后仍具有光学活性 | |
| C. | 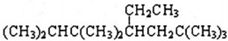 的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 | |
| D. | 2-甲基-1,3-丁二烯在一定温度下和Br2按物质的量之比1:1发生加成反应,所得产物主要有三种 |
4.化学用语在化学学习中有着重要的作用.下列有关化学用语使用正确的是( )
| A. | CO2的电子式 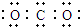 | B. | Cl-的结构示意图 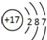 | ||
| C. | HCl的电子式 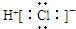 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
5.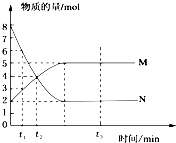 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )| A. | 0~t2内用M表示的平均反应速率是 $\frac{2}{{t}_{2}}$(mol•L-1•min-1) | |
| B. | t1~t2内容器内的压强逐渐减小 | |
| C. | 该反应的方程式为N?2M | |
| D. | t2与t3时刻的混合气体的平均相对分子质量相等 |
 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.