题目内容
 为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.
为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.(1)该反应的化学平衡常数可表示为K=
(2)250℃时,将2mol CO和6mol H2充入4L的密闭容器中,经5min后反应达到平衡状态,测得c(CO)=0.1mol?L-1,则用H2表示的化学反应速率为
(3)保持容器容积不变,下列措施能提高甲醇产率的是
a.充入稀有气体,增大体系压强 b.将CH3OH(g)从体系中分离
c.升高反应温度或使用催化剂 d.按原比例再充入 CO和 H2
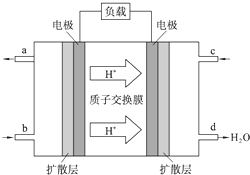
(4)甲醇燃料电池的工作原理如图所示.
①该电池工作时,c口通入的物质发生
②该电池负极电极反应为:
③该燃料电池中9.6g甲醇完全反应生成CO2时,反应中转移电子为
考点:化学平衡常数的含义,化学电源新型电池,化学平衡的影响因素
专题:化学平衡专题,电化学专题
分析:(1)根据平衡常数的表达式写出反应的CO(g)+2H2(g)═CH3OH(g)平衡常数K;根据K(250℃)=2.041,K(300℃)=0.270可知,温度升高平衡常数减小,数目升高温度平衡向着逆向移动,据此判断该反应的焓变;
(2)根据5min内一氧化碳的浓度变化计算出用H2表示的化学反应速率;根据一氧化碳浓度减小的量计算出其转化率;
(3)能提高甲醇产率,说明改变条件后平衡向着正向移动,根据化学平衡及其影响因素对各选项进行判断;
(4)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,c口通入氧气发生还原反应;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算.
(2)根据5min内一氧化碳的浓度变化计算出用H2表示的化学反应速率;根据一氧化碳浓度减小的量计算出其转化率;
(3)能提高甲醇产率,说明改变条件后平衡向着正向移动,根据化学平衡及其影响因素对各选项进行判断;
(4)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,c口通入氧气发生还原反应;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算.
解答:
解:(1)反应CO(g)+2H2(g)═CH3OH的平衡常数为:K=
;
已知K(250℃)=2.041,K(300℃)=0.270,升高温度后平衡常数减小,说明升高温度化学平衡向着逆向移动,该反应的逆反应为吸热反应,则正反应为 放热反应,△H<0,
故答案为:
;<;
(2)250℃时,将2mol CO和6mol H2充入4L的密闭容器中,反应前一氧化碳的浓度为:0.5mol/L,经5min后反应达到平衡状态,测得c(CO)=0.1mol?L-1,CO的浓度变化为:0.5mol/L-0.1mol/L=0.4mol/L,则5min内氢气消耗的浓度为:0.4mol/L×2=0.8mol/L,则用H2表示的化学反应速率为:v=
=0.16mol/(L?min);
达到平衡状态时CO的转化率为:
×100%=80%,
故答案为:0.16; 80%;
(3)a.充入稀有气体,增大体系压强:由于各组分的浓度不变,所以化学平衡不发生移动,甲醇的产率不会增加,故a错误;
b.将CH3OH(g)从体系中分离:生成物浓度减小,化学平衡向着正向移动,可以提高甲醇的产率,故b正确;
c.升高反应温度或使用催化剂:升高温度,平衡向着逆向移动,甲醇的产率减小;使用催化剂不影响甲醇的转化率,故c错误;
d.按原比例再充入一氧化碳和氢气:该反应是体积缩小的反应,再按照原比例充入一氧化碳和氢气后,相当于增大了压强,平衡向着正向移动,反应物转化率增大,故甲醇的产率增大,故d正确;
故答案为:bd;
(4)①据氢离子移动方向知,右侧电极为正极,左侧电极为负极,c口通入的是氧气,氧气在反应中达到电子被还原,发生还原反应,
故答案为:还原;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH-12e-+2H2O=2CO2↑+12H+,
故答案为:2CH3OH-12e-+2H2O=2CO2↑+12H+;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当9.6g甲醇完全反应生成CO2时,转移电子的物质的量为:
×6=1.8mol,
故答案为:1.8.
| c(CH 3OH) |
| c(CO)?c2(H 2) |
已知K(250℃)=2.041,K(300℃)=0.270,升高温度后平衡常数减小,说明升高温度化学平衡向着逆向移动,该反应的逆反应为吸热反应,则正反应为 放热反应,△H<0,
故答案为:
| c(CH 3OH) |
| c(CO)?c2(H 2) |
(2)250℃时,将2mol CO和6mol H2充入4L的密闭容器中,反应前一氧化碳的浓度为:0.5mol/L,经5min后反应达到平衡状态,测得c(CO)=0.1mol?L-1,CO的浓度变化为:0.5mol/L-0.1mol/L=0.4mol/L,则5min内氢气消耗的浓度为:0.4mol/L×2=0.8mol/L,则用H2表示的化学反应速率为:v=
| 0.8mol/L |
| 5min |
达到平衡状态时CO的转化率为:
| 0.4mol/L |
| 0.5mol/L |
故答案为:0.16; 80%;
(3)a.充入稀有气体,增大体系压强:由于各组分的浓度不变,所以化学平衡不发生移动,甲醇的产率不会增加,故a错误;
b.将CH3OH(g)从体系中分离:生成物浓度减小,化学平衡向着正向移动,可以提高甲醇的产率,故b正确;
c.升高反应温度或使用催化剂:升高温度,平衡向着逆向移动,甲醇的产率减小;使用催化剂不影响甲醇的转化率,故c错误;
d.按原比例再充入一氧化碳和氢气:该反应是体积缩小的反应,再按照原比例充入一氧化碳和氢气后,相当于增大了压强,平衡向着正向移动,反应物转化率增大,故甲醇的产率增大,故d正确;
故答案为:bd;
(4)①据氢离子移动方向知,右侧电极为正极,左侧电极为负极,c口通入的是氧气,氧气在反应中达到电子被还原,发生还原反应,
故答案为:还原;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH-12e-+2H2O=2CO2↑+12H+,
故答案为:2CH3OH-12e-+2H2O=2CO2↑+12H+;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当9.6g甲醇完全反应生成CO2时,转移电子的物质的量为:
| 9.2g |
| 32g/mol |
故答案为:1.8.
点评:本题考查了化学平衡常数、化学反应速率的计算、化学平衡及其影响因素、原电池工作原理等知识,题目难度中等,试题题量较大,涉及的知识点较多,充分考查了学生对所学知识的掌握情况,注意明确化学平衡常数、化学反应速率的概念及计算方法,明确原电池工作原理,能够正确书写电极反应式.

练习册系列答案
相关题目
下列有关实验说法中,错误的是( )
| A、葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 |
| B、酸碱中和滴定时,未用待测液润洗锥形瓶,对测定结果无影响 |
| C、向某溶液中加入足量盐酸无现象,再加入BaCl2溶液生成白色沉淀说明有SO42- |
| D、在无色溶液中先加入氯水、再加入CCl4,振荡静置,下层溶液显红棕色说明有Br- |
在盐类发生水解的过程中正确的说法是( )
| A、盐的电离平衡被破坏 |
| B、水的电离度逐渐增大 |
| C、溶液的pH发生改变 |
| D、没有中和反应发生 |
 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):