题目内容
将铂丝插入KOH溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池.根据两极上反应的实质判断,通入甲烷的一极为电池的 _极,这一极的电极反应式为 .
考点:化学电源新型电池
专题:电化学专题
分析:根据得失电子判断燃料电极的正负极,根据得失电子及产物的性质写出电极反应式;
解答:
解:燃料燃烧时失电子发生氧化反应,为原电池的负极,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物,能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;
点评:本题考查了化学电源新型电池,根据得失电子确定正负极上通入的气体,难点是电极反应式的书写,注意碱性条件下甲烷失电子不能生成二氧化碳,要生成碳酸根离子,为易错点.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列化学用语表达正确的是( )
A、乙酸分子比例模型: | ||
B、原于核内有18个中于的氯原干:
| ||
C、铬原于价电子层排布图 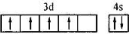 | ||
D、过氧化氢电子式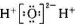 |
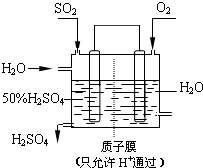 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤. 有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).
有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).





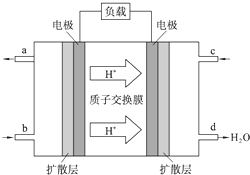 为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.
为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.