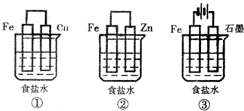
题目内容
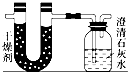 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
(1)实验完毕后,生成物中水的质量为
(2)生成的水中氢元素的质量为
(3)生成的二氧化碳中碳元素的质量为
(4)该燃料中碳元素与氢元素的质量比为
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为
考点:有关有机物分子式确定的计算,测定有机物分子的元素组成
专题:烃及其衍生物的燃烧规律
分析:(1)因为该燃料含C、H、O三种元素,故燃烧产物为CO2和H2O,由题意可知U形管增加的质量为吸收水的质量,广口瓶增加的质量为生成的CO2质量,生成的正盐为CaCO3,根据碳原子守恒计算CaCO3的物质的量,再根据m=nM计算CaCO3的质量;
(2)根据水的分子式中H元素质量分数计算;
(3)根据碳元素守恒、结合m=nM计算二氧化碳中C元素质;
(4)由元素守恒,结合(2)(3)中的数据计算;
(5)确定氧化物中C、H原子数目之比,结合醇的每个分子中含有一个氧原子,确定该醇的分子式与结构简式.
(2)根据水的分子式中H元素质量分数计算;
(3)根据碳元素守恒、结合m=nM计算二氧化碳中C元素质;
(4)由元素守恒,结合(2)(3)中的数据计算;
(5)确定氧化物中C、H原子数目之比,结合醇的每个分子中含有一个氧原子,确定该醇的分子式与结构简式.
解答:
解:(1)因为该燃料含C、H、O三种元素,故燃烧产物为CO2和H2O,由题意可知U形管增加的质量为吸收水的质量:102.9g-101.1g=1.8g,
广口瓶增加的质量为生成的CO2质量:314.2g-312.0g=2.2g,CO2的物质的量=
=0.05mol,广口瓶中生成的正盐为CaCO3,根据C原子守恒可知生成CaCO3 0.05mol,其质量为0.05mol×100g/mol=5g,
故答案为:1.8;5;
(2)水中含H元素质量为1.8×
=0.2g,故答案为:0.2;
(3)生成的0.05mol CO2,含C元素质量为0.05mol×12g/mol=0.6g,故答案为:0.6;
(4)根据C、H元素守恒,该燃料中m(C):m(H)=0.6g:0.3g=3:1,故答案为:3:1.
(5)有机物分子中N(C):N(H)=0.05mol:
=1:4,故有机物分子中只能有1个C原子,H原子数目为4,醇的每个分子中含有一个氧原子,故该醇的分子式为CH4O,结构简式为CH3OH,
故答案为:CH4O;CH3OH.
广口瓶增加的质量为生成的CO2质量:314.2g-312.0g=2.2g,CO2的物质的量=
| 2.2g |
| 44g/mol |
故答案为:1.8;5;
(2)水中含H元素质量为1.8×
| 2 |
| 18 |
(3)生成的0.05mol CO2,含C元素质量为0.05mol×12g/mol=0.6g,故答案为:0.6;
(4)根据C、H元素守恒,该燃料中m(C):m(H)=0.6g:0.3g=3:1,故答案为:3:1.
(5)有机物分子中N(C):N(H)=0.05mol:
| 0.2g |
| 1g/mol |
故答案为:CH4O;CH3OH.
点评:本题考查有机物的燃烧法和元素守恒法是确定有机物分子式,难度不大,(5)中注意根据C、H原子数目之比确定有机物分子中C、H原子数目.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、在反应KIO3+6 HI=KI+3I2十3 H2O中,每生成3mo1 I2转移的电子数为5NA |
| B、100mL 18.4mo1?L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA |
| C、1 L 0.1 moI?L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA |
| D、将0.lmol FeC13滴人沸水中可制得0.1NA Fe(OH)3胶粒 |
下列说法正确的是(??)
| A、不含其他杂质的天然油脂属于纯净物 |
| B、肥皂的有效成分硬脂酸钠和甘油 |
| C、油脂的烃基部分饱和程度越大,熔点越低 |
| D、各种油脂水解后的产物中都有甘油 |
 有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).
有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应). 为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.
为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇. 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线: