题目内容
铜片、锌片连接后浸入稀硫酸中构成原电池,当导线上通过3.01×1022个电子时,锌失去电子 mol,锌片质量减少 g.铜片表面析出氢气 L(标准状况).
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极反应式为2H++2e-=H2↑,结合电极反应式进行相关的计算.
解答:
解:锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极反应式为2H++2e-=H2↑,
当导线上通过3.01×1022个电子时,转移电子为
=0.05mol,锌失去电子0.05mol,锌片质量减少为
×0.05mol×65g/mol=1.625g,铜片表面析出氢气体积为0.025mol×22.4L/mol=0.56L,
故答案为:0.05;1.625;0.56.
当导线上通过3.01×1022个电子时,转移电子为
| 3.01×1022 |
| 6.02×1023/mol |
| 1 |
| 2 |
故答案为:0.05;1.625;0.56.
点评:本题考查原电池知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握电极反应式的书写,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
只能表示一个化学反应的离子方程式为( )
| A、BaCO3+2CH3COOH═Ba2++CO2↑+H2O+2CH3COO- |
| B、Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓ |
| C、CH3COOH+OH-═CH3COO-+H2O |
| D、Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ |
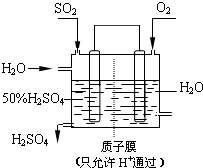 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤. 为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.
为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇. 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线: