题目内容
4.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )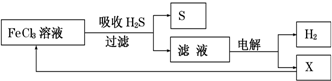
| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
分析 A、根据Fe3+的氧化性和H2S的还原性,再根据离子方程式正误的判断;
B、根据氯化亚铁溶液中离子的放电顺序结合实验还能制取H2和S得情况来判断;
C、根据电极反应式以及电子守恒进行计算即可,注意气体的体积和物质的量之间的计算关系;
D、H2S充分燃烧的产物为二氧化硫.
解答 解:A、由图中的流程图可知,FeCl3与H2S反应生成S和Fe2+,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故A正确;
B、电解的是氯化亚铁和盐酸溶液,在阴极区域产生的是氢气,为了制得氢气,应该是采用阳离子交换膜,让氢离子通过,阳极发生的应该是氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-(或根据图示循环),电解时阳极反应式为Fe2+-e-═Fe3+,故B错误;
C、电解过程中若阴极产生2.24L氢气,在标况下,其物质的量为:0.1mol,根据阴极反应:2H++2e-=H2↑,则转移电子是0.2mol,电解时阳极反应式先是:Fe2+-e-═Fe3+,阳极区产生0.2mol Fe3+,故C错误;
D、由于H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,生成的SO2也是一种有毒气体,故D错误.
故选:A.
点评 本题考查的知识点较多,电解池的工作原理、离子方程式正误判断、电极反应式的书写,试题的综合性较强.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
19.已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是( )X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W.
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
13.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2$\frac{\underline{\;催化剂\;}}{\;}$CO2+H2O.下列有关说法正确的是( )
HCHO+O2$\frac{\underline{\;催化剂\;}}{\;}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |


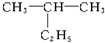 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.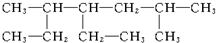 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷.
 .
.