题目内容
9.化学实验设计和操作中必须十分重视安全问题和环境保护问题.下列实验问题处理方法不正确的是( )①配制稀硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸.
②在气体发生装置上直接点燃一氧化碳气体时,必须先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法收集一试管气体,点燃气体,听爆鸣声.
③实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室.
④给试管中的液体加热时不时移动试管,以免暴沸伤人.
⑤不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛.
| A. | ②③ | B. | ②⑤ | C. | ③④ | D. | ①③ |
分析 ①浓硫酸稀释放热;
②根据检验纯度时一氧化碳的收集方法进行分析判断;
③根据实验室废液的处理方法进行分析判断;
④根据给试管中的液体加热时的注意事项进行分析判断;
⑤酸溅到眼睛中,眨眼会使眼睛被冲洗的更完全.
解答 解:①浓硫酸稀释放热,若将水注入浓硫酸中会引起溶液的沸腾而导致溶液溅出,故应将浓硫酸注入水中,故①正确;
②用排空气法收集的气体不纯净,不能用于检验纯度,应用排水法收集,故②错误;
③实验结束后不能将所有的废液倒入下水道排出实验室,以免腐蚀下水道、污染环境,故③错误;
④试管内液体若受热不均匀,液体会冲出试管,为避免因液体冲出伤人,故要不时移动试管或加入碎瓷片,故④正确;
⑤不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,使眼睛被彻底清洗,故⑤正确;
故选A.
点评 本题考查化学实验安全及事故处理,难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
19.利用碳酸钠晶体(Na2CO3•10H2O)来配制0.5mol•L-1的碳酸钠溶液1000mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A. | 称取碳酸钠晶体100g | |
| B. | 定容时俯视观察刻度线 | |
| C. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤 | |
| D. | 定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
20.X、Y、Z、W、R是五种常见的前四周期元素,原子序数依次增大,其相关信息如下表:
(1)元素W在周期表中的位置是第三周期,第ⅥA族,R基态原子的价电子排布式为3d54s1.
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
17.下面的反应中,氨作为氧化剂参加反应的是( )
| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O |
4.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )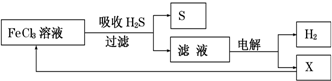

| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
14.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有组试剂的洗气瓶 …( )
| A. | 澄清石灰水、浓H2SO4 | B. | KMnO4(H+)、浓H2SO4 | ||
| C. | 溴水、NaOH溶液、浓H2SO4 | D. | 浓H2SO4、KMnO4(H+)、NaOH溶液 |
1.下列有关化学用语表示正确的是( )
| A. | Na2O2的电子式为 | B. | NH4Br的电子式: | ||
| C. | 氢氧根离子的电子式: | D. | HClO的电子式: |
18.最简式相同,既不是同系物,又不是同分异构体的是( )
| A. | 1辛烯和3甲1丁烯 | B. | 苯和乙炔 | ||
| C. | 正丁烷和2甲基丙烷 | D. | 甲苯和乙苯 |
 .
. .
. .
. 、
、 、
、 、
、 .
.