题目内容
15.A、B、C、D、E五种固态物质中均含有同一种元素,它们能发生如图所示的变化.试回答:
(1)写出有关物质的化学式:CNa2SiO3;EH2SiO3.
(2)写出有关反应的化学方程式:
①A-→D:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
②A-→B:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
分析 A、B、C、D、E五种物质中均含有同一种元素,A与碳在高温下反应生成D,D 能与氢氧化钠反应生成C,C与过量盐酸生成E,E加热生成A,根据这一转化关系可推知,A为SiO2,D为Si,C为Na2SiO3,E为H2SiO3,在高温下与石灰石反应生成B为CaSiO3,Na2SiO3与氯化钙反应也生成CaSiO3,符合各物质转化关系,据此答题.
解答 解:A、B、C、D、E五种物质中均含有同一种元素,A与碳在高温下反应生成D,D 能与氢氧化钠反应生成C,C与过量盐酸生成E,E加热生成A,根据这一转化关系可推知,A为SiO2,D为Si,C为Na2SiO3,E为H2SiO3,在高温下与石灰石反应生成B为CaSiO3,Na2SiO3与氯化钙反应也生成CaSiO3,符合各物质转化关系,
(1)根据上面的分析可知,C为Na2SiO3,E为H2SiO3,
故答案为:Na2SiO3;H2SiO3;
(2)①A-→D的反应为碳还原二氧化硅,反应方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,②A-→B反应方程式为SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO;SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
点评 本题以硅为载体考查了无机物的推断,根据硅、二氧化硅、硅酸盐之间的转化关系来分析解答,注意:二氧化硅和碳在高温下反应生成CO而不是二氧化碳,为易错点.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
5.下列仪器中,能在酒精灯火焰上直接加热的玻璃仪器是( )
| A. | 试管 | B. | 蒸发皿 | C. | 烧杯 | D. | 蒸馏烧瓶 |
6.下列叙述正确的是( )
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
3.已知弱酸的电离平衡常数如下表:下列选项正确的是( )
| 弱酸 | H2CO3 | 水杨酸(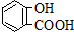 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于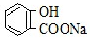 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→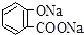 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
10.下列离子方程式不正确的是( )
| A. | 向硅酸钠溶液中通入少量CO2气体 SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 将Cu片插入FeCl3溶液中 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 向烧碱溶液中滴加少量Al2(SO4)3溶液 Al3++4OH-═[Al(OH)4]- | |
| D. | 将Ag丝插入NaNO3和H2SO4的混合液中 3Ag+4H++NO3-═3Ag++NO↑+2H2O |
20.X、Y、Z、W、R是五种常见的前四周期元素,原子序数依次增大,其相关信息如下表:
(1)元素W在周期表中的位置是第三周期,第ⅥA族,R基态原子的价电子排布式为3d54s1.
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
4.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )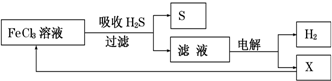

| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |


 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.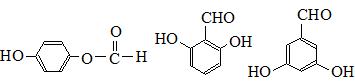 (任写一种).
(任写一种).