题目内容
14.有A、B、C、D四种元素,试按下述所给的条件推断:①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;C是地壳中含量最大的金属元素;
②D是非金属元素,它跟氢化合可生成气态氢化物HD,在室温时,D的单质是液体,易挥发,需液封保存;
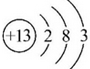
(1)B位于周期表中第三周期第IIA族,C的原子结构示意图是
(2)A元素与D元素形成化合物的电子式是
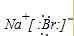 .
.(3)在上述四种元素中,最高价氧化物对应的水化物碱性最强的物质的化学式是NaOH,酸性最强的物质的化学式是HBrO4.
(4)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
分析 有A、B、C、D四种元素,A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、C是地壳中含量最大的金属元素,则C为Al,那么B为Mg;D是非金属元素,它跟氢化合可生成气态氢化物HD,在室温时,D的单质是液体,易挥发,需液封保存,则D为Br,据此解答即可.
解答 解:有A、B、C、D四种主族元素,A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、C是地壳中含量最大的金属元素,则C为Al,那么B为Mg;D是非金属元素,它跟氢化合可生成气态氢化物HD,在室温时,D的单质是液体,易挥发,需液封保存,则D为Br,
(1)B是镁元素,Mg元素位于周期表中第三周期第ⅡA族,C为铝元素,Al原子的结构示意图为: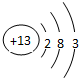 ,故答案为:三;ⅡA;
,故答案为:三;ⅡA; ;
;
(2)A元素与D元素化合物为NaBr,溴化钠为离子化合物,钠离子直接用离子符号表示,溴离子需要标出最外层电子及所带电荷,溴化钠的电子式为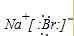 ,故答案为:
,故答案为: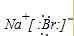 ;
;
(3)Na元素的金属性最强,所以碱性最强的NaOH,F没有最高价含氧酸,其它元素中酸性最强的为HBrO4,故答案为:NaOH;HBrO4;
(4)C的氧化物对应的水化物为氢氧化铝,A的氧化物对应水化物为NaOH,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,离子方程式为Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,题目比较基础,需要学生全面掌握基础知识.

练习册系列答案
相关题目
4.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )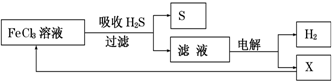

| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
9.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的相对分子质量 | D. | 气体的总物质的量 |
6.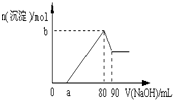 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |
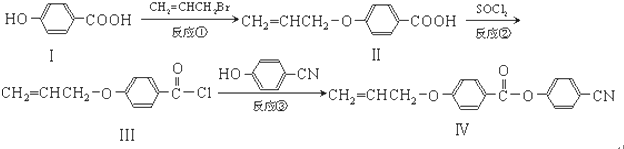
 .
.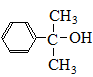 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是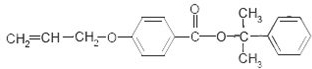 .
.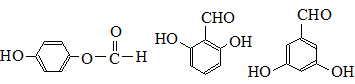 (任写一种).
(任写一种). .
.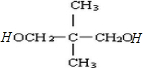 .
.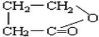 .
.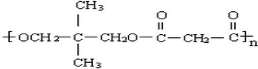 .
.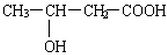 、
、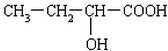 、
、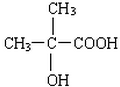 、
、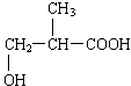 .
.
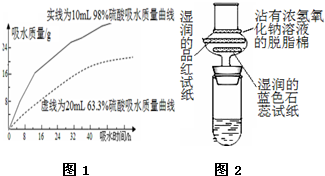 浓硫酸在高中化学实验中有着很重要的作用
浓硫酸在高中化学实验中有着很重要的作用