题目内容
16.对不纯的固体有机物进行提纯,常用的方法是重结晶法,该法主要要求溶剂:(1)杂质在溶剂中的溶解度很大或很小.
(2)被提纯有机物在该溶剂中的溶解度受温度影响较大.
分析 重结晶是利用混合物中各组分在某种溶剂中溶解度不同或在同一溶剂中不同温度时的溶解度不同而使它们相互分离.
解答 解:在进行重结晶时,理想的溶剂必须具备下列条件:
(1)不与被提纯物质起化学反应.(2)在较高温度时能溶解多量的被提纯物质;而在室温或更低温度时,只能溶解很少量的该种物质.(3)对杂质溶解非常大或者非常小(前一种情况是要使杂质留在母液中不随被提纯物晶体一同析出;后一种情况是使杂质在热过滤的时候被滤去).(4)容易挥发(溶剂的沸点较低),易与结晶分离除去.(5)能结出较好的晶体.(6)无毒或毒性很小,便于操作.(7)价廉易得.
故答案为:杂质在溶剂中的溶解度很大或很小;被提纯有机物在该溶剂中的溶解度受温度影响较大.
点评 本题考查重结晶的原理,注意溶剂选择的条件,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
4.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )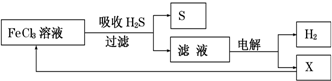

| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
11.下列实验操作使测定(或配制)结果偏高的是( )
| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
1.下列有关化学用语表示正确的是( )
| A. | Na2O2的电子式为 | B. | NH4Br的电子式: | ||
| C. | 氢氧根离子的电子式: | D. | HClO的电子式: |
6. 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |

 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.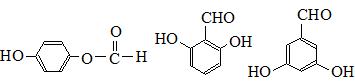 (任写一种).
(任写一种).