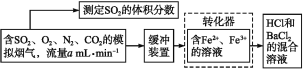
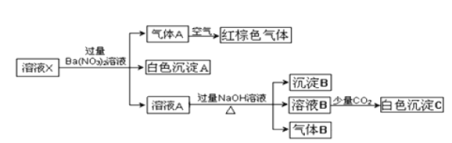
题目内容
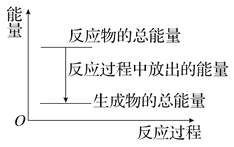
【题目】某晶体 M·nH2O溶于水后,溶液温度降低。而 M(s)溶于水后,溶液温度升高,可将变化过程表示为图。下列说法中错误的是( )
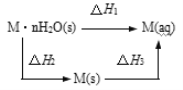
A.△H1=△H2+△H3
B.M(s)溶于水形成溶液△S>0
C.△H2>△H3
D.△H1+△H3>△H2
【答案】D
【解析】
A.根据盖斯定律可知,总反应的热效应等于各分步反应的热效应之和,因此△H1=△H2+△H3,故A正确;
B.M(s)溶于水形成溶液,混乱度增大,熵变增大,△S>0,故B正确;
C.M(s)溶于水后,溶液温度升高,△H3<0,晶体 MnH2O 溶于水后,溶液温度降低,△H1>0,根据盖斯定律可知,△H1=△H2+△H3,△H2=△H1△H3>0,所以△H2>△H3,故C正确;
D.根据盖斯定律可知,总反应的热效应等于各分步反应的热效应之和,因此△H1=△H2+△H3,故△H1+△H3=△H2+2△H3;M(s)溶于水后,溶液温度升高,△H3<0,故△H1+△H3<△H2,故D错误;
故答案选D。

练习册系列答案
相关题目
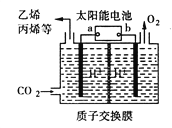
【题目】用石墨电极完成下列电解实验。
实验装置 | 实验现象 |
| a处试纸变蓝; b处变红,局部褪色; c处无明显变化; d处试纸变蓝 |
下列对实验现象的解释或推测不合理的是
A. a为电解池的阴极
B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e- = Fe3+
D. d处:2H2O+2e-=H2↑+2OH-