题目内容
【题目】第ⅤA族元素的原子R与Cl原子结合形成RCl3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
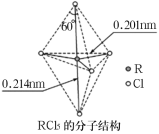
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°三种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R—Cl键键能不都相同
【答案】A
【解析】
A. R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10, A错误;
B.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120°、180°三种,B正确;
C. RCl5![]() RCl3+Cl2↑,则RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3,C正确;
RCl3+Cl2↑,则RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3,C正确;
D. 键长越短,键能越大,键长不同,所以键能不同,D正确;故答案为:A。

 名校课堂系列答案
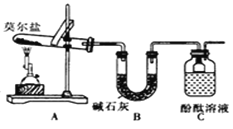
名校课堂系列答案【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
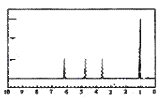
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |