题目内容
【题目】SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:
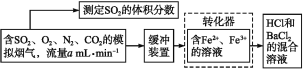
(1)写出Fe3+将SO2反应的离子方程式:__。
(2)若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,现已测得气体流量和模拟烟气中SO2的体积分数,还需要测定的数据是___。
(3)向滴有紫色石蕊溶液的试管中通入SO2气体,现象是__;若再向其中滴入足量的氯水,现象是__,涉及反应的化学方程式为___。
【答案】2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ BaSO4沉淀的质量、时间 紫色石蕊溶液变红 滴加时,开始时溶液为红色,一段时间后,红色逐渐褪去 SO2+Cl2+2H2O=H2SO4+2HCl、Cl2+H2OHCl+HClO
【解析】
流程利用铁离子的强氧化性,使烟气中的二氧化硫转化为硫酸根离子,通过生成硫酸钡的量测定烟气中二氧化硫的含量。
(1)根据题给信息,SO2被Fe3+氧化成SO42-,则Fe3+被还原为Fe2+,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)已知气体的流量a mL·min-1,求气体的量,就必须要知道通入气体的时间,欲知道SO2的量,还要知道生成BaSO4沉淀的质量;
(3)SO2水溶液呈酸性,注意SO2虽有漂白性,但不能漂白石蕊溶液,现象为紫色石蕊溶液变红;向其中滴入氯水,氯水中的氯气与二氧化硫反应生成硫酸和盐酸,溶液呈酸性,溶液仍为红色,当消耗完二氧化硫后,氯水中的次氯酸氧化石蕊,使溶液红色逐渐褪去;涉及的反应为SO2+Cl2+2H2O=H2SO4+2HCl、Cl2+H2OHCl+HClO。

 阅读快车系列答案
阅读快车系列答案【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L