题目内容
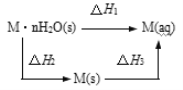
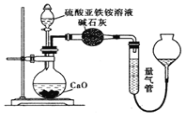
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,其制备过程如图所示。下列分析不正确的是( )
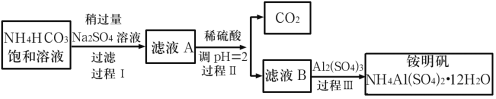
A.过程Ⅰ发生的反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.向铵明矾溶液中逐滴加入NaOH溶液,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
C.检验溶液B中阴离子的试剂仅需BaCl2溶液
D.若省略过程Ⅱ,则铵明矾的产率明显降低
【答案】B
【解析】
NaHCO3的溶解度较小,所以在饱和碳酸氢铵溶液中加入过量的硫酸钠溶液会产生NaHCO3沉淀,过滤后得含有(NH4)2SO4和少量的NaHCO3的滤液,将滤液用稀硫酸调节pH值为2,使NaHCO3生成硫酸钠,得含有(NH4)2SO4和少量硫酸钠的溶液B,在B溶液中加入硫酸铝可得铵明矾。
A.根据上面的分析可知,过程I的反应为2NH4HCO3+Na2SO4═2NaHCO3↓+(NH4)2SO4,故A正确;
B.向铵明矾溶液中逐滴加入NaOH溶液,先有氢氧化铝沉淀产生,后产生氨气,再后来氢氧化钠与氢氧化铝反应,沉淀消失,所以观察到的现象为白色沉淀生成→刺激性气体逸出→白色沉淀消,故B错误;
C.B为(NH4)2SO4和少量硫酸钠的混合溶液,阴离子为硫酸根离子,且溶液呈酸性,所以检验溶液B中阴离子的试剂仅需BaCl2溶液,故C正确;
D.若省略过程II,则溶液中少量的碳酸氢钠会与硫酸铝发生双水解,使铵明矾产率明显减小,故D正确;
故选B。

【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06