题目内容
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
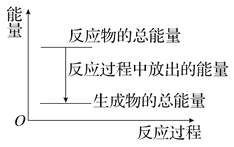
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
【答案】A
【解析】根据能量守恒,则反应物的总能量高于生成物的总能量,该反应为放热反应,锌和硫酸反应为放热反应, A正确;反应物的总能量高于生成物的总能量,反应物和生成物均有两种,无法比较1molZn和1molH2的能量大小,B错误;若将其设计为原电池,锌化合价升高,失电子,则锌作负极,C错误;若将其设计为原电池,当有32.5gZn溶解时,消耗锌的物质的量为0.5mol,根据反应方程式可知生成0.5molH2,但气体所处状态未知,不能确定气体体积,D错误;正确选项A。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
【题目】根据下列实验现象,所得结论错误的是( )
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.A
B.B
C.C
D.D