题目内容
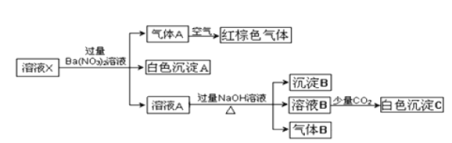
【题目】某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对X溶液进行如下实验,下列结论正确的是( )(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)
A.原溶液中一定存在NH4+、Fe2+、SO42-B.原溶液中可能合有NO3-和Al3+
C.白色沉淀C可能是![]() D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
【答案】A
【解析】
在该溶液中逐滴加入稀盐酸至过量,无明显现象,说明肯定不含CO32-,得到X溶液,对X溶液加入过量的Ba(NO3)2产生白色沉淀为BaSO4,气体A遇空气变成红棕色,则气体A为NO,则原溶液中肯定含有Fe2+、SO42-,溶液A加入足量的NaOH后,产生气体B和沉淀B,则气体B为NH3,由于前边加入了过量的Ba(NO3)2已经把Fe2+全部氧化成Fe3+,所以沉淀B为Fe(OH)3;溶液B通少量CO2后有白色沉淀生成,白色沉淀有可能是Al(OH)3或BaCO3 一种或两种,而原溶液中各离子浓度均为0.5mol/L,可根据电荷守恒和物料守恒来确定其它离子。
在该溶液中逐滴加入稀盐酸至过量,无明显现象,说明肯定不含CO32-,得到X溶液,对X溶液加入过量的Ba(NO3)2产生白色沉淀为BaSO4,气体A遇空气变成红棕色,则气体A为NO,则原溶液中肯定含有Fe2+、SO42-,无NO3-,溶液A加入足量的NaOH后,产生气体B和沉淀B,则气体B为NH3,由于前边加入了过量的Ba(NO3)2已经把Fe2+全部氧化成Fe3+,所以沉淀B为Fe(OH)3;溶液B通少量CO2后有白色沉淀生成,白色沉淀有可能是Al(OH)3或BaCO3 一种或两种。则原溶液中肯定有Fe2+、SO42-、NH4+,无CO32-、NO3-,原溶液中各离子浓度均为0.5mol/L,根据电荷和物料守恒,原溶液中肯定会含有Cl-,可能含有Al3+、Na+。
A. 原溶液中一定存在NH4+、Fe2+、SO42--,A项正确;
B. 原溶液中可能合有Na+和Al3+,没有NO3-,B项错误;
C. 白色沉淀C可能是![]() 和Ba(OH)2,C项错误;
和Ba(OH)2,C项错误;
D. 沉淀B肯定是Fe(OH)3,无Fe(OH)2,D项错误。
答案选A。

【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。
(1)下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 |
|
| 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中对应位置__________(以下为周期表的一部分)
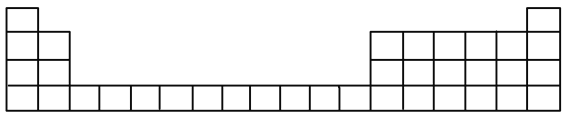
(2)![]() 元素处于周期表中______周期______族
元素处于周期表中______周期______族
(3)在元素周期表中______的分界处,可以找到制半导体材料的元素
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是______(填化学式)
(5)C、E形成化合物为______(填化学式)