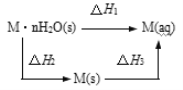
题目内容
【题目】叠氮化钠(NaN3)是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①关闭止水夹K2,打开止水夹K1,开始制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,停止通入氨气并关闭止水夹K1。
③向装置A中的b容器内充入加热介质,并加热到210~220℃,然后打开止水夹K2,制取并通入N2O。
请回答下列问题:
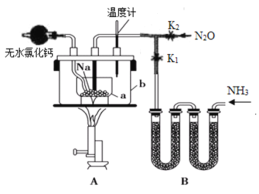
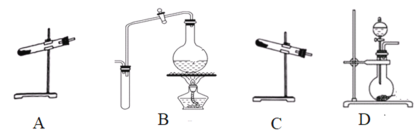
(1)制取氨气可选择的装置是__(填序号,下同),N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__。
(2)步骤①中先通氨气的目的是__,步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__,步骤③中最适宜的加热方式为___。
(3)生成NaN3的化学方程式为___。
(4)反应完全结束后,进行以下操作,得到NaN3固体:
a中混合物![]() NaN3固体
NaN3固体
已知NaNH2能与水反应生成NaOH和氨气。操作Ⅱ的目的是___,操作Ⅳ最好选用的试剂是___。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500g试样配成500.00mL溶液。②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示剂,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑、Ce4++Fe2+=Ce3++Fe3+,试样中NaN3的质量分数为___。
【答案】BCD A 排尽装置中的空气 2Na+2NH3![]() 2NaNH2+H2 油浴加热 NaNH2+N2O
2NaNH2+H2 油浴加热 NaNH2+N2O![]() NaN3+H2O 降低NaN3的溶解度 乙醚 93.60%
NaN3+H2O 降低NaN3的溶解度 乙醚 93.60%
【解析】
(1)实验室可以选用氯化铵与消石灰共热或用浓氨水与新制生石灰(或氢氧化钠固体)或用浓氨水共热制备氨气,由于硝酸铵的熔点低于分解温度,所以用硝酸铵制备一氧化二氮时应防止硝酸铵熔化流出试管;
(2)金属钠具有很强的还原性,能与空气中的氧气反应,步骤①中应先通氨气的目的是用氨气排尽装置中的空气;步骤②的反应为氨气与熔化的钠反应生成氨基钠和氢气;步骤③为210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水;
(3)由题意可知,210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水;
(4)叠氮化钠固体微溶于乙醇,不溶于乙醚,操作Ⅱ加入乙醇可降低NaN3的溶解度,促使NaN3析出,操作Ⅳ选用乙醚,减少晶体的损失,有利于产品快速干燥;
(5)(NH4)2Ce(NO3)6的总的物质的量为0.1010mol/L×50×10-3L=0.00505 mol,部分与叠氮化钠反应,剩余的(NH4)2Ce(NO3)6用(NH4)2Fe(SO4)2标准溶液滴定,由此计算可得。
(1)实验室可以选用装置C用氯化铵与消石灰共热制备氨气,也可以选用装置D用浓氨水与新制生石灰(或氢氧化钠固体)反应快速制备氨气,还可以选用装置B用浓氨水共热制备氨气,则装置BCD均可以用于制备氨气;由于硝酸铵的熔点低于分解温度,所以用硝酸铵制备一氧化二氮时,为防止硝酸铵熔化流出试管,试管口应向上,则制备一氧化二氮的装置为A,故答案为:BCD;A;
(2)金属钠具有很强的还原性,能与空气中的氧气反应,则步骤①中先通氨气的目的是用氨气排尽装置中的空气,防止加热时空气中的氧气等能与钠反应;步骤②的反应为氨气与熔化的钠反应生成氨基钠和氢气,反应的化学方程式为2Na+2NH3![]() 2NaNH2+H2;步骤③为210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水,则最适宜的加热方式为油浴加热,故答案为:排尽装置中的空气;2Na+2NH3
2NaNH2+H2;步骤③为210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水,则最适宜的加热方式为油浴加热,故答案为:排尽装置中的空气;2Na+2NH3![]() 2NaNH2+H2;油浴加热;
2NaNH2+H2;油浴加热;
(3)由题意可知,210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水,反应的化学方程式为NaNH2+N2O![]() NaN3+H2O,故答案为:NaNH2+N2O
NaN3+H2O,故答案为:NaNH2+N2O![]() NaN3+H2O;
NaN3+H2O;
(4)由叠氮化钠固体易溶于水,微溶于乙醇,不溶于乙醚可知,操作Ⅱ加入乙醇的目的是可降低NaN3的溶解度,促使NaN3析出,操作Ⅳ最好选用乙醚,目的是减少晶体的溶解损失,且乙醚易挥发,有利于产品快速干燥,故答案为:降低NaN3的溶解度;乙醚;
(5)(NH4)2Ce(NO3)6的总的物质的量为0.1010mol/L×50×10-3L=0.00505 mol,部分与叠氮化钠反应,剩余的(NH4)2Ce(NO3)6用(NH4)2Fe(SO4)2标准溶液滴定,根据反应:Ce4++Fe2+===Ce3++Fe3+,参与反应的(NH4)2Ce(NO3)6与标准液的物质的量相等,则参与反应的(NH4)2Ce(NO3)6物质的量为0.050 0 mol/L×29.00×10-3L=0.001 45 mol,故与叠氮化钠反应的(NH4)2Ce(NO3)6有0.005 05 mol-0.001 45 mol=0.003 6 mol,根据反应方程式可得NaN3~(NH4)2Ce(NO3)6,则2.500 g试样中叠氮化钠的质量为0.003 6 mol×65 g/mol×![]() =2.34g,试样中NaN3的质量分数为
=2.34g,试样中NaN3的质量分数为![]() ×100%=93.60%,故答案为:93.60%。
×100%=93.60%,故答案为:93.60%。

【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
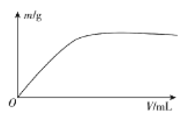
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |