题目内容
4. 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
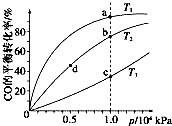
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
分析 (1)依据反应②的平衡常数随温度变化判断反应能量变化;
(2)平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合反应①+②得到反应③,可得平衡常数K3=K1×K2;
(3)计算浓度商和平衡常数比较分析判断反应进行方向;
(4)依据影响化学反应速率的因素和影响平衡移动的因素及根据平均摩尔质量=$\frac{总质量}{总物质的量}$进行判断.
解答 解:(1)反应②CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数随温度升高增大,说明平衡正向进行,正反应是吸热反应;
故答案为:吸热;
(2)平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合反应①+②得到反应③,可得平衡常数K3=K1•K2;
故答案为:K1•K2;
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.8mol•L-1、0.3mol•L-1、0.15mol•L-1,Q=$\frac{0.3×0.15}{0.{8}^{3}×0.1}$=0.88<K=2.5,则此时v正>v逆,故答案为:>;
(4)A.根据反应①中温度与K的关系,可推断该反应为放热反应,升温,平衡左移,CO的转化率减小,所以T3>T2>T1,故A错误;
B.反应速率v(c)>v(a),v(b)>v(d),故B错误;
C.温度越高,平衡常数越小,压强对平衡常数无影响,所以K(a)>K(c),K(b)=K(d),故C正确;
故选C.
点评 本题考查了化学平衡、反应速率影响因素分析判断,平衡常数计算应用,掌握反应特征和平衡移动原理是关键,题目难度中等.

练习册系列答案
相关题目
15.在一定温度下,b g固体A能完全溶于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解肯定不可能是( )
| A. | $\frac{100b}{a}$g | B. | $\frac{200b}{a}$g | C. | $\frac{100b}{a+b}$g | D. | $\frac{100(a+b)}{a}$g |
12.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 碱石灰 | 氧化铝 | 二氧化硫 |
| C | 水银 | 水玻璃 | 铁 | 碳酸钙 |
| D | 食醋 | 水煤气 | 氯化铜 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
19.几种短周期元素的原子半径及主要化合价如下表:
根据上表下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
9.下列反应中,氧化剂与还原剂的物质的量的比值从大到小的顺序排列正确的是( )
①2Na2O2+2CO2═2NaCO3+O2↑
②3S+6NaOH═2Na2S+Na2SO3+3H2O
③KClO3+6HCl═KCl+3Cl2↑+3H2O.
①2Na2O2+2CO2═2NaCO3+O2↑
②3S+6NaOH═2Na2S+Na2SO3+3H2O
③KClO3+6HCl═KCl+3Cl2↑+3H2O.
| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ②③① |
13.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是( )
| A. | 漂白粉的成分是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |