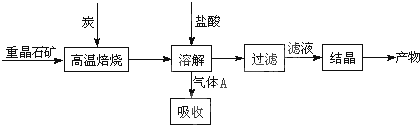
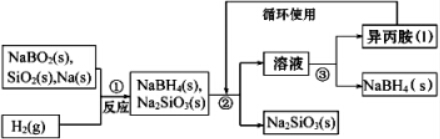
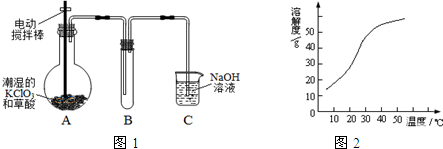
题目内容
12.常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,则反应后溶液中离子浓度从大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).分析 常温下,pH=3的盐酸溶液中c(HCl)=0.001mol/L,一水合氨是弱电解质,部分电离,所以pH=11的氨水浓度大于0.01mol/L,二者等体积混合时氨水有剩余,导致溶液呈碱性,结合电荷守恒判断离子浓度大小.
解答 解:常温下,pH=3的盐酸溶液中c(HCl)=0.001mol/L,一水合氨是弱电解质,部分电离,所以pH=11的氨水浓度大于0.01mol/L,二者等体积混合时氨水有剩余,导致溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒得c(Cl-)<c(NH4+),一水合氨电离程度较小,所以溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确混合溶液中溶质及其性质是解本题关键,注意结合电荷守恒分析解答,题目难度不大.

练习册系列答案
相关题目
13.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是( )
| A. | 漂白粉的成分是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |
17.常温下,下列叙述正确的是( )
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于10.5 |
2.配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是( )
| A. | 未冷却即转移、定容 | B. | 容量瓶中原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线 | D. | 玻璃棒在刻度线上方引流溶剂水 |