题目内容
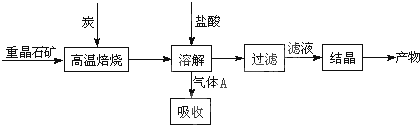
8.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图1:
已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注
 和
和 .
.
分析 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸酸解PH=1,得到溶液硫酸镁、硫酸钙、硫酸锰、硫酸铁、硫酸亚铁、硫酸铝,加入次氯酸钠氧化亚铁离子为铁离子,沉淀锰离子,过滤后的滤液中利用溶解度随温度变化,除去硫酸钙,得到硫酸镁溶液,通过蒸发浓缩趁热过滤得到MgSO4•7H2O;
(1)影响反应速率的外界因素通常有温度和浓度,固体溶解时还可以通过搅拌、粉碎;
(2)次氯酸根离子具有强的氧化性,除能够氧化二价锰离子生成二氧化锰;因亚铁离子也具有还原性,能够被次氯酸钠氧化,生成的Fe3+很容易水解生成Fe(OH)3;
(3)硼镁泥主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,其中酸溶时只有SiO2不溶于水,生成的CaSO4是微溶于水的,经氧化调整溶液pH后,还有Fe(OH)3、Al(OH)3、MnO2不溶物生成,都可以通过过滤进入滤渣;
(4)根据表中温度对硫酸镁、硫酸钙的影响完成,温度越高,硫酸钙溶解度越小,滤液蒸发结晶后得到的晶体,可利用过滤得到;
(5)根据硼镁泥中MgO的质量分数(占40%),计算出生成MgSO4•7H2O质量及产率;
(6)金属的防腐措施有多种,利用电化原理防护的牺牲阳极的阴极保护法和外接电源的阴极保护法.
解答 解:硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸酸解PH=1,得到溶液硫酸镁、硫酸钙、硫酸锰、硫酸铁、硫酸亚铁、硫酸铝,加入次氯酸钠氧化亚铁离子为铁离子,沉淀锰离子,过滤后的滤液中利用溶解度随温度变化,除去硫酸钙,得到硫酸镁溶液,通过蒸发浓缩趁热过滤得到MgSO4•7H2O;
(1)在酸解过程中,可以通过升高温度、将固体粉碎、适当提高硫酸溶液的浓度并用玻璃棒搅拌等来加快酸解时的化学反应速率,
故答案为:适当升温;把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,生成的Fe3+很容易水解生成Fe(OH)3的离子方程式为Fe3++3H2O═Fe(OH)3+3H+,总反应式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
(3)滤渣的成分包括Fe(OH)3、Al(OH)3、MnO2、SiO2及少量微溶的CaSO4,则还有SiO2、CaSO4,故答案为:SiO2、CaSO4;
(4)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙,“操作I”是将滤液继续蒸发浓缩,冷却结晶,通过过滤洗涤得到MgSO4•7H2O,故答案为:趁热过滤;过滤洗涤;
(5)100g硼镁泥中氧化镁的物质的量为=$\frac{100g×40%}{40g/mol}$=1mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,MgSO4•7H2O的产率为$\frac{172.2g}{246g}$×100%=70.0%,故答案为:70.0%;
(6)金属镁可用于自然水体中铁件的电化学防腐有二种方式,一是与铁形成原电池,镁为负极,另一种是电解池,铁连接电源的负极,镁作阳极,具体连接方式为 和
和 ,
,
故答案为: 和
和 .
.
点评 本题考查了从硼镁泥中提取MgSO4•7H2O的方法,涉及配制一定物质的量浓度的溶液的仪器选择、铁离子检验方法、物质分离的方法,产率计算等,侧重考查学生分析问题能力,题目难度较大.

①2Na2O2+2CO2═2NaCO3+O2↑
②3S+6NaOH═2Na2S+Na2SO3+3H2O
③KClO3+6HCl═KCl+3Cl2↑+3H2O.
| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ②③① |
| A. | 氯化氢溶于水生成盐酸,盐酸是电解质,氯化氢是非电解质 | |
| B. | NH3 溶于水生成NH3•H2O,NH3•H2O是电解质,NH3是非电解质 | |
| C. | 电解质的水溶液一定能导电,非电解质的水溶液一定不能导电 | |
| D. | 液态CH3COOH不能导电,所以醋酸是非电解质 |
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于10.5 |
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{{F}^{-}}{C({H}^{+})}$ | D. | $\frac{({F}^{-})}{C(HF)}$ |