题目内容
5.用双线桥分析下列氧化还原反应,并指出氧化剂还原剂.(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2+2H2O
(2)2KClO3═2KCl+3O2↑
分析 (1)化合价升高元素是Cu,所以反应物Cu是还原剂,化合价降低的是N元素,所以反应物HNO3是氧化剂,转移电子数为2;
②反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12
解答 解:(1)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即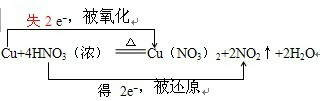 ,
,
故答案为: ;氧化剂HNO3;还原剂Cu;
;氧化剂HNO3;还原剂Cu;
(2)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,氧化剂和还原剂都是KClO3,转移电子数为12,用双线桥表示其电子转移情况为: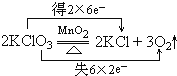 ,
,
故答案为: ;氧化剂KClO3;还原剂KClO3.
;氧化剂KClO3;还原剂KClO3.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
15.在一定温度下,b g固体A能完全溶于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解肯定不可能是( )
| A. | $\frac{100b}{a}$g | B. | $\frac{200b}{a}$g | C. | $\frac{100b}{a+b}$g | D. | $\frac{100(a+b)}{a}$g |
13.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是( )
| A. | 漂白粉的成分是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |
20.下列化学反应属于吸热反应的是( )
| A. | 碘的升华 | B. | 生石灰溶于水 | C. | 镁与稀盐酸反应 | D. | 氨气分解 |
10.下列关于电解质、非电解质的说法正确的是( )
| A. | 氯化氢溶于水生成盐酸,盐酸是电解质,氯化氢是非电解质 | |
| B. | NH3 溶于水生成NH3•H2O,NH3•H2O是电解质,NH3是非电解质 | |
| C. | 电解质的水溶液一定能导电,非电解质的水溶液一定不能导电 | |
| D. | 液态CH3COOH不能导电,所以醋酸是非电解质 |
17.亚氯酸钠(NaClO2)与足量浓盐酸反应制备环保型消毒剂二氧化氯(ClO2),在该反应中,还原剂与还原产物的物质的质量之比为( )
| A. | 4:5 | B. | 1:1 | C. | 1:5 | D. | 4:1 |