题目内容
13.室温下将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1=△H2+△H3 | D. | △H1+△H2>△H3 |
分析 胆矾溶于水时,溶液温度降低,反应为CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;
CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2;
已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H3,根据盖斯定律确定之间的关系.
解答 解:①胆矾溶于水时,溶液温度降低,反应为CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;
②CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;
③已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H3;
依据盖斯定律①-②得到③,所以△H3=△H1-△H2;△H2<0,△H1>0,则△H3>0,
A、上述分析可知△H2<△H3,故A错误;
B、分析可知△H2=△H1-△H3,由于△H2<0,△H3>△H1 ,故B错误;
C、△H3=△H1-△H2,故C正确;
D、△H2<0,△H1>0、△H3>△H1+△H2,故D错误;
故选C.
点评 本题考查了物质溶解及物质分解过程中的能量变化,根据盖斯定律分析物质溶解过程中的能量变化是解题关键,题目难度中等.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
8.下列指定微粒的数目可能不等的是( )
| A. | 等物质的量的氯气和液氯中含有的分子数 | |
| B. | 等质量的红磷和白磷中含有的原子数 | |
| C. | 同温、同体积的CO和NO的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
18.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{{F}^{-}}{C({H}^{+})}$ | D. | $\frac{({F}^{-})}{C(HF)}$ |
2.配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是( )
| A. | 未冷却即转移、定容 | B. | 容量瓶中原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线 | D. | 玻璃棒在刻度线上方引流溶剂水 |

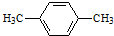 .
. 可简写为
可简写为 .降冰片烯的结构可表示为:
.降冰片烯的结构可表示为: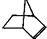
 .
.