题目内容
19.常温下,下列关于电解质溶液的说法正确的是( )| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
分析 A、CH3COOH溶液加水稀释10倍,溶液中氢氧根离子浓度增加;
B、常温下pH=7的溶液呈中性,则溶液中存在c(H+)=c(OH-),CH3COONa溶液呈碱性,要使CH3COOH和NaOH混合溶液呈中性,则n(CH3COOH)应该稍微大些;
C、向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液,得到的是盐酸和氯化铵的混合物,据物料守恒来判断;
D、在含0.1mol NaHSO4溶液中,完全电离出钠离子、氢离子和硫酸根离子,溶液中存在电荷守恒.
解答 解:A、CH3COOH溶液加水稀释10倍,溶液中氢氧根离子浓度增加,其余离子浓度是减小的,故A错误;
B、常温下pH=7的溶液呈中性,则溶液中存在c(H+)=c(OH-),CH3COONa为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,要使CH3COOH和NaOH混合溶液呈中性,则n(CH3COOH)>n(NaOH),因为c(NaOH)=c(CH3COOH),则V(CH3COOH溶液)<V(NaOH溶液),故B错误;
C、向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液,得到的是等浓度盐酸和氯化铵的混合物,存在电荷守恒:c(Cl-)+c(OH-)=c(H+)+c(NH4+)
,但是c(NH3•H2O)≠c(NH4+),故C错误;
D、在含0.1mol NaHSO4溶液中,能完全电离出钠离子、氢离子和硫酸根离子,根据溶液中电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-),但是硫酸根离子和钠离子浓度是相等的,所以c(H+)=c(SO42-)+c(OH-),故D正确.
故选D.
点评 本题考查电解质溶液中离子浓度的大小比较,涉及离子平衡中的守恒问题以及电离和水解相关知识,难度不大.


| A. | b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) | |
| B. | d点溶液存在的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) | |
| C. | 图2中的e点对应图1中的c点 | |
| D. | 在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:
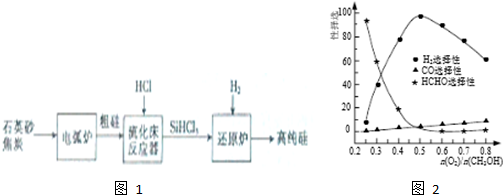
①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
| A. | 2~3之间 | B. | 3~4之间 | C. | 4~5之间 | D. | 5~6之间 |
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | 小苏打溶液中加入足量稀盐酸:HCO3-+H+=CO2↑+H2O | |
| D. | 电解饱和食盐水的阴极反应:2Cl--2e-=Cl2↑ |
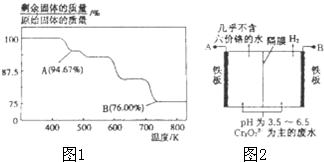 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.