题目内容
14.酸雨这一环境污染现象是因为过度燃烧煤及石油产生的,某次酸雨分析结果如下:c(NH4+)=2.0×10-6mol/L;c(Cl-)=6.0×10-6mol/L;c(Na+)=3.0×10-6mol/L;c(NO3-)=2.3×10-5mol/L;c(SO42-)=2.8×10-5mol/L.则此次酸雨的pH为( )| A. | 2~3之间 | B. | 3~4之间 | C. | 4~5之间 | D. | 5~6之间 |
分析 任何电解质溶液中都存在电荷守恒,根据电荷守恒计算酸雨中氢离子浓度,再根据pH计算公式计算溶液pH,据此分析解答.
解答 解:根据电荷守恒得2c(SO42-)+c(Cl-)+c(NO3-)=c(NH4+)+c(Na+)+c(H+),
则2.8×10-5mol•L-1×2+6.0×10-6mol•L-1+2.3×10-5mol•L-1=2.0×10-6mol•L-1 +3.0×10-6mol•L-1+c(H+),则c(H+)=8.0×10-5mol•L-1,则溶液的pH=-lgc(H+)=-lg8.0×10-5≈4.1,
故选C.
点评 本题考查了pH简单计算,正确计算溶液中氢离子浓度是解本题关键,注意守恒思想的运用,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
5.已知25℃时有关弱酸的电离平衡常数如下表:
下列关于Na2CO3溶液说法不正确的是( )
| 弱酸化学式 | HCN | H2CO3 |
| 电离平衡常数(25℃) | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | Na2CO3溶液中滴入等体积、等浓度的盐酸后,溶液中一定存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-) | |
| B. | Na2CO3溶液中通一定量的CO2气体后,溶液中一定存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | Na2CO3溶液加水稀释后,c(H+)增大 | |
| D. | Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN |
2.化学与生活密切相关,下列说法不正确的是( )
| A. | Na2O2可用作供氧剂 | |
| B. | 硅胶多孔,吸水能力强,常用作袋装食品的干燥剂 | |
| C. | SO2具有漂白性,常用药食品的漂白 | |
| D. | K2FeO4可用于水的净化 |
9.最近,科学家在甲烷的低温活化与二氧化碳加氢制取乙酸的研究上取得了突破,其反应原理如下:CH4$→_{-H_{2}}^{催化剂}$CHX$→_{H_{2}}^{CO_{2}}$CH3COOH,下列说法错误的是( )
| A. | CO2、CH3COOH均为共价化合物 | |
| B. | 每生成1molCH3COOH,要消耗22.4LCO2 | |
| C. | CO2、CH3COOH分子中均含σ键和π键 | |
| D. | CH4$→_{-H_{2}}^{催化剂}$CHX属于氧化反应 |
19.常温下,下列关于电解质溶液的说法正确的是( )
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
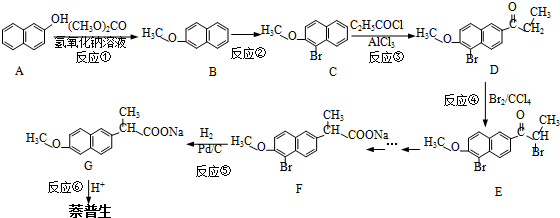
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 .
.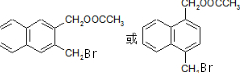 (任写一种).
(任写一种). 的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)