题目内容
9.已知:在25℃时,向10mL 0.01mol•L-1NaCN溶液中逐滴加入0.01mol•L-1的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是( )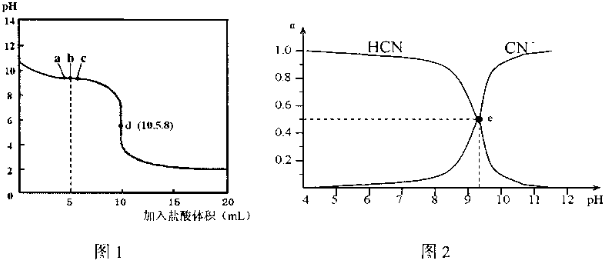
| A. | b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) | |
| B. | d点溶液存在的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) | |
| C. | 图2中的e点对应图1中的c点 | |
| D. | 在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
分析 A.b点时,溶液呈碱性,此时溶液中溶质为等物质的量浓度的c(NaCN)=c(NaCl)=c(HCN),CN-的水解程度大于HCN的电离程度;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.图2中的e点是HCN、NaCN浓度相等,而图1中的c点是两者恰好完全反应后继续滴加盐酸,促进CN-的水解,使CN-的离子浓度变小;
D.两者恰好完全反应时d点溶液呈酸性,所以应用酸性范围内变化的指示剂甲基橙减小误差.
解答 解:A.b点时,溶液呈碱性,此时溶液中溶质为等物质的量浓度的c(NaCN)=c(NaCl)=c(HCN),CN-的水解程度大于HCN的电离程度,所以c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+),故A错误;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据物料守恒得c(Cl-)=c(HCN)+c(CN-),而根据电荷守恒可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),则c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),故B正确;
C.图2中的e点是HCN、NaCN浓度相等,而图1中的c点是两者恰好完全反应后继续滴加盐酸,促进CN-的水解,使CN-的离子浓度变小,所以应增强溶液的pH值,所以图2中的e点对应图1中的a点,故C错误;
D.两者恰好完全反应时d点溶液呈酸性,所以应用酸性范围内变化的指示剂甲基橙减小误差,故D错误.
故选B.
点评 本题考查离子浓度大小比较,侧重考查学生分析判断能力,明确每一点发生的反应、溶液中的溶质及离子浓度大小是解本题关键,易错选项是D.

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
17.下列说法不正确的是( )
| A. | 钠和钾的合金具有导电性,可用于中子反应堆热交换剂 | |
| B. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 |
14.关于酯的组成,下列叙述错误的是( )
| A. | 酯的一般通式是RCOOR′和R′可以相同,也可以不同 | |
| B. | RCOOR′和R′可以是脂肪烃基,也可以是芳香烃基 | |
| C. | 在RCOOR′中,当R和R′均为-CH3时,这种酯叫甲酸甲酯 | |
| D. | 碳原子数相同的饱和一元羧酸和饱和一元酯互为同分异构体 |
1.下列图示对应的叙述相符的是( )
| A. |  由图可知:H2的燃烧热为241.8kJ•mol-1 | |
| B. |  图中表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强比甲的压强大 | |
| C. |  如图,若除去CuSO4溶液中的Fe2+,可向溶液中加入适量CuO,调节pH=4,过滤 | |
| D. | 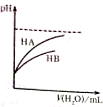 如图表示常温下HA、HB两种酸加水稀释时溶液pH的变化,则相同条件下,NaA溶液的pH大于NaB溶液的pH |
18.下列说法中正确的是( )
| A. | 原电池放电过程中,负极质量一定减轻,正极质量一定增加 | |
| B. | 常温下浓硫酸与铝不反应,所以常温下可用铝制贮罐贮运浓硫酸 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12 H2O(g)△H<0该反应一定能自发进行 | |
| D. | 提取海带中的碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
19.常温下,下列关于电解质溶液的说法正确的是( )
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
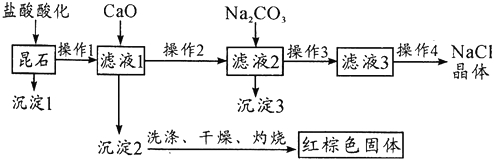
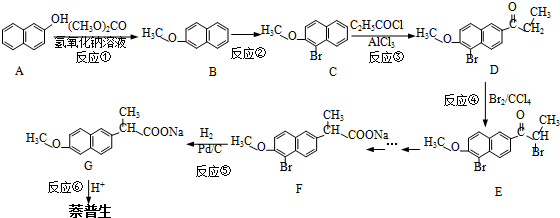
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 .
.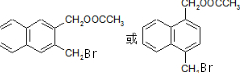 (任写一种).
(任写一种). 的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)