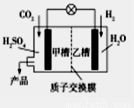
题目内容
12.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2H++2CrO42-(黄色)①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42-和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
分析 A、溶液由橙色变为黄色,溶液由黄色变为橙色,说明加入酸碱发生平衡移动;
B、氧化剂的氧化性大于氧化产物分析判断;
C、CrO42-具有氧化剂酸性溶液中氧化亚铁离子;
D、稀释溶液,平衡状态下离子浓度减小,氢离子浓度减小,溶液中存在离子积,氢氧根离子浓度增大.
解答 解:A、加入氢氧化钠溶液,溶液由橙色变为黄色,说明平衡正向进行,加入硫酸溶液由黄色变为橙色,说明平衡逆向进行,说明加入酸碱发生平衡移动,实验①能证明K2Cr2O7溶液中存在上述平衡,实验②不能证明K2Cr2O7溶液中存在上述平衡,故A错误;
B、反应中Cr2O72-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O,氧化剂的氧化性大于氧化产物,所以实验②能说明氧化性:Cr2O72->Fe3+,故B正确;
C、CrO42-具有氧化剂酸性溶液中氧化亚铁离子,CrO42-和Fe2+在酸性溶液中不可以大量共存,故C错误;
D、稀释K2Cr2O7溶液时,平衡状态下离子浓度减小,氢离子浓度减小,由离子积不变可知,氢氧根离子浓度增大,故D错误;
故选B.
点评 本题考查了盐类水解的分析应用,氧化还原反应的规律分析,平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
3.生活中碰到的某些问题,常涉及到化学知识,下列说法正确的是( )
| A. | 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 | |
| D. | 碳酸铝是一种应用很广的食品添加剂,可大量添加到馒头、面包等食品中 |
17.心酮胺是治疗冠心病的药物,其结构简式如下图,下列描述中正确的是( )
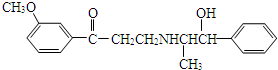
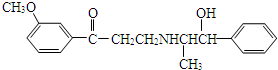
| A. | 该分子中含有酚羟基 | |
| B. | 该物质可以和浓氢溴酸发生取代反应 | |
| C. | 该物质可以和银氨溶液发生银镜反应 | |
| D. | 该分子苯环上的一氯取代物有6种 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L 1 mol•L-1AlCl3溶液中含有的Al3+数目为NA | |
| C. | 在标况下,11.2L氯气通入足量的NaOH溶液中转移电子数为NA | |
| D. | 18g重水(D2O)含有的中子数为10 NA |
1.下列离子方程式正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- |
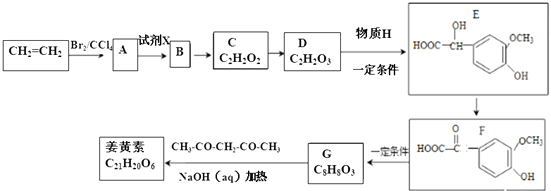
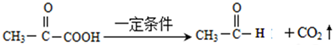

 .
.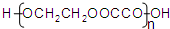 .
.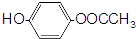 .
.