题目内容
12.下列说法正确的是( )| A. | 利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解 | |
| B. | 与Al反应放出H2的溶液中Mg2-、Ca2-、HCO3-、NO3-有可能大量共存 | |
| C. | Ca(ClO)2溶液中通入过量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 等体积、等物质的量浓度的NaX的弱酸HX混合后的溶液中c(Na+)>c(HX)>c(H+)>c(OH-) |
分析 A.明矾水解生成胶体,具有丁达尔现象;
B.与Al反应放出H2的溶液含有大量的H+或OH-;
C.ClO-具有强氧化性能把SO2氧化为SO42-;
D.不能判断HX的电离程度与X-的水解程度的大小关系,则不能确定溶液的酸碱性.
解答 解:A.利用一束强光照射明矾溶液,产生光亮的“通路”,可知有胶体分散系,即说明明矾一定发生了水解,故A正确;
B.与Al反应放出H2的溶液含有大量的H+或OH-,HCO3-在酸性和碱性条件下均不能存在,故B错误;
C.HClO具有强氧化性能把SO2氧化为SO42-,反应不能生成HSO3-,故C错误;
D.不能判断HX的电离程度与X-的水解程度的大小关系,则不能确定溶液的酸碱性,所以不能判断离子浓度大小的关系,故D错误;
故选A.
点评 本题考查了胶体的性质、离子共存、氧化还原反应及胶体性质、离子浓度大小比较等,注重把握有关原理及物质性质的考查,题目难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
16.已知某溶液可能含有NH4+、Na+、Mg2+、Al3+、HCO3-、Cl-、NO2-、SO42-中的几种离子.现取3份,此溶液,分别进行如下实验:
①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
| A. | 气体甲可能为纯净物 | |
| B. | 该溶液中一定存在NH4+、Al3+、NO2-、SO42- | |
| C. | 该溶液中一定不存在Na+、Mg2+、HCO3-、Cl- | |
| D. | 无法确定Na+、HCO3-、NO2-是否存在 |
3.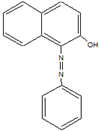 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
20.从如表实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
17.表1是元素周期表的一部分( 注意:以下各空所涉及的元素填元素符号,不能用字母代替)
(1)C的元素符号为Al;
(2)C的离子的结构示意图 ,
,
(3)用电子式表示AE2的形成过程 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
(2)C的离子的结构示意图
 ,
,(3)用电子式表示AE2的形成过程
 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
1.已知:弱酸HX(aq)与NaOH(aq)反应的中和热△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的中和热△H=-55.6kJ•mol-1.则HX在水溶液中电离的△H 等于( )
| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |