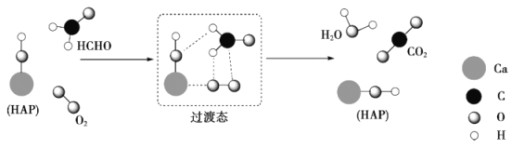
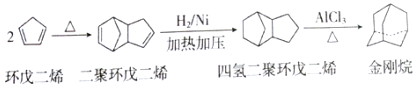
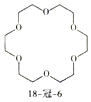
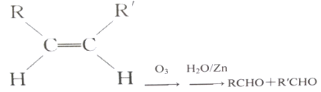题目内容
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
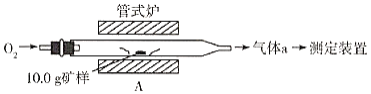
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。
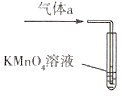
①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
【答案】6CuFeS2 + 19O2![]() 2Fe3O4+6CuO+ 12SO2 5 SO2 +2H2O + 2
2Fe3O4+6CuO+ 12SO2 5 SO2 +2H2O + 2![]() =5
=5![]() +2Mn2+ +4H+ 32.0% Fe(OH)2,Fe(OH)3 坩埚(坩埚钳)、泥三角 Fe3+能氧化I-为I2,2Fe3++2I-=2Fe2++I2,干扰Cu2+的检测 淀粉 32.0%
+2Mn2+ +4H+ 32.0% Fe(OH)2,Fe(OH)3 坩埚(坩埚钳)、泥三角 Fe3+能氧化I-为I2,2Fe3++2I-=2Fe2++I2,干扰Cu2+的检测 淀粉 32.0%
【解析】
I硫含量的测定原理:高温下将矿样中的硫转化为SO2,之后利用高锰酸钾将二氧化硫氧化成硫酸根,在加入氯化钡溶液得到硫酸钡沉淀,通过硫酸钡沉淀的量来确定二氧化硫的含量;
Ⅱ.铁、铜的含量测定原理:取其中一份加入过量的氨水生成沉淀,Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+,则得到的沉淀为:Fe(OH)2、Fe(OH)3,灼烧后得到氧化铁,称重以计算铁的量;将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,再加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2,通过测定I2的量来间接测定铜的量。
,再加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2,通过测定I2的量来间接测定铜的量。
(1)O2是氧化剂,CuFeS2是还原剂,根据给出的物质的量之比和质量守恒,可写出A中发生反应的化学方程式为6CuFeS2 + 19O2![]() 2Fe3O4 +6CuO + 12SO2。
2Fe3O4 +6CuO + 12SO2。
(2)①KMnO4溶液氧化SO2的生成硫酸,高锰酸钾被还原为硫酸锰,结合电荷守恒、原子守恒和电子守恒书写离子方程式:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
②向反应后的溶液中加入过量的BaCl2溶液,沉淀为BaSO4,由物料守恒知n(S)=n(BaSO4)=![]() =0.10 mol,m(S)=0.10 mol ×32 gmol-1=3.20 g,则矿样中硫的质量分数为
=0.10 mol,m(S)=0.10 mol ×32 gmol-1=3.20 g,则矿样中硫的质量分数为![]() ;
;
(3)根据分析可知加入过量的氨水得到的沉淀是氢氧化亚铁和氢氧化铁,灼烧固体在坩埚中,灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到坩埚、坩埚钳、泥三角;
(4)因为2Cu2+ +4I-=2CuI+I2,故2Cu2+~I2~2Na2S2O3,n(Cu2+)=n(Na2S2O3)=1.00 molL-1×25.00 × 10-3 L=0.025 mol,m(Cu)=0.025 mol ×64 gmol-1 =1.6 g,其在矿样中铜的质量分数是![]() 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】五氧化二钒用作冶金添加剂,占五氧化二钒总消耗量的 80%以上,其次是用作有机化工的催化剂。为了增加V2O5 的利用率,我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等) 中回收 V2O5 的一种生产工艺流程示意图:
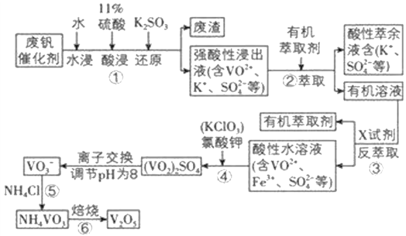
部分含钒物质在水中的溶解性如表所示,回答下列问题:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)①中废渣的主要成分是 __________________________;①中V2O5 发生反应的离子方程式为 ___________________________ 。
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层) 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ______________________;实验室进行萃取操作使用的玻璃仪器为 ______________________。
(3)实验室用的原料中V2O5 占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 molL -1 的KClO3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是 __________________[M(V2O5)=182 gmol -1]。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
试判断在实际生产时,⑤中加入 NH4Cl 调节溶液的最佳 pH为____________;若钒沉淀率为 93.1%时不产生 Fe(OH)3 沉淀,则此时溶液中 c(Fe3+)≤____________ (已知:25℃时Ksp[Fe(OH)3]=2.6×10 -39)。