题目内容
【题目】五氧化二钒用作冶金添加剂,占五氧化二钒总消耗量的 80%以上,其次是用作有机化工的催化剂。为了增加V2O5 的利用率,我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等) 中回收 V2O5 的一种生产工艺流程示意图:
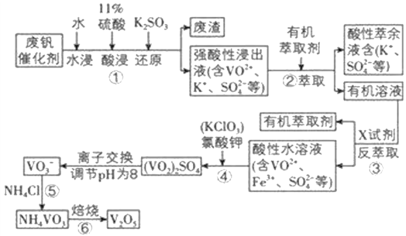
部分含钒物质在水中的溶解性如表所示,回答下列问题:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)①中废渣的主要成分是 __________________________;①中V2O5 发生反应的离子方程式为 ___________________________ 。
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层) 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ______________________;实验室进行萃取操作使用的玻璃仪器为 ______________________。
(3)实验室用的原料中V2O5 占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 molL -1 的KClO3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是 __________________[M(V2O5)=182 gmol -1]。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
试判断在实际生产时,⑤中加入 NH4Cl 调节溶液的最佳 pH为____________;若钒沉淀率为 93.1%时不产生 Fe(OH)3 沉淀,则此时溶液中 c(Fe3+)≤____________ (已知:25℃时Ksp[Fe(OH)3]=2.6×10 -39)。
【答案】SiO2 V2O5+4H++SO32-=2VO2++SO42-+2H2O 加入碱,中和H2SO4,使平衡正移 分液漏斗、烧杯 91.0% 1.7 2.6×10 -3 molL -1
【解析】
生产流程:废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等),据物质的水溶性确定,V2O5和SiO2难溶于水,因为亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,过滤得到滤渣为二氧化硅,强酸性浸出液含有VO2+、K+、SO42-,加入有机萃取剂萃取分液得到有机溶液中VO2+,再加入X试剂进行反萃取分液,分离出有机层得到水层是含VO2+、Fe3+、SO42-的酸性水溶液,根据Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层),加入的碱会和平衡体系中的氢离子反应促进平衡正向进行,加入硫酸抑制平衡正向进行,氯酸钾具有氧化性,能将VO2+氧化为VO2+,加入氨水,调节溶液pH到最佳值,得到NH4VO3,最后焙烧得到五氧化二钒即可。
RAn(有机层)+nH+(水层),加入的碱会和平衡体系中的氢离子反应促进平衡正向进行,加入硫酸抑制平衡正向进行,氯酸钾具有氧化性,能将VO2+氧化为VO2+,加入氨水,调节溶液pH到最佳值,得到NH4VO3,最后焙烧得到五氧化二钒即可。
(1)根据上述分析可知①中废渣的主要成分是二氧化硅,①中V2O5 发生反应的离子方程式为V2O5+4H++SO32-=2VO2++SO42-+2H2O,故答案为:SiO2;V2O5+4H++SO32-=2VO2++SO42-+2H2O;
(2)反萃取时,根据VOSO4 (水层)+2HA2(有机层)![]() VOA2(有机层)+H2SO4(水层)可知,为提高②中萃取百分率,则加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;萃取分液操作时,用到的玻璃仪器有分液漏斗和烧杯,故答案为:加入碱,中和H2SO4,使平衡正移;分液漏斗、烧杯;
VOA2(有机层)+H2SO4(水层)可知,为提高②中萃取百分率,则加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;萃取分液操作时,用到的玻璃仪器有分液漏斗和烧杯,故答案为:加入碱,中和H2SO4,使平衡正移;分液漏斗、烧杯;
(3)结合得失电子守恒和原子守恒配平得到加入氯酸钾时发生的反应的离子方程式为ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,根据该离子方程式可得如下关系:3V2O5~6VO2+~ ClO3-,100mL0.1mol/L的KClO3溶液中ClO3-物质的量为n(ClO3-)=0.1L×0.1mol/L=0.01mol,则对应的V2O5的物质的量为0.03mol,质量为0.03mol×182g/mol=5.46g,则该实验中钒的回收率是![]() ,故答案为:91.0%;
,故答案为:91.0%;
(4)从沉淀率和pH关系可知,随pH增大,沉淀率先增大后减小,故沉淀率最大的pH即为最佳pH,pH=1.7时钒的沉淀率最大为98.8%,加入氨水调节溶液的最佳pH为为1.7,若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时溶液pH=2,计算氢氧根离子浓度c(OH-)=10-12mol/L,K[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)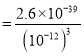 =2.6×10-3mol/L,故答案为:1.7;2.6×10-3mol/L。
=2.6×10-3mol/L,故答案为:1.7;2.6×10-3mol/L。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) |
|
|
|
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1