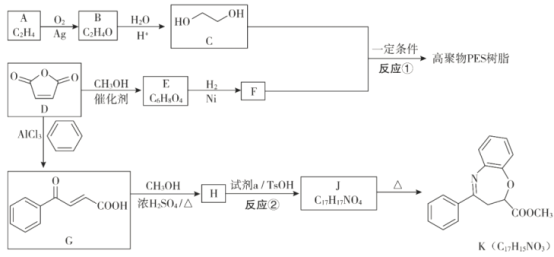
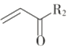
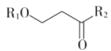
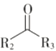
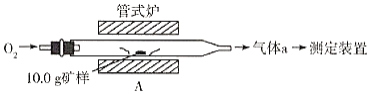
题目内容
【题目】锡酸钠(Na2SnO3)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,一种由锡精矿制备锡酸钠的工艺流程如图:
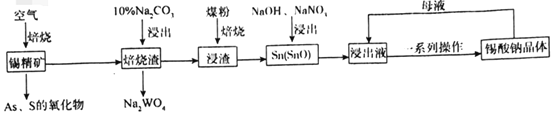
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②锡酸钠易溶于水,其溶解度随着温度的升高而降低。
请回答下列问题:
(1)Na2SnO3中锡元素的化合价为___,从焙烧渣中除去Fe3O4最简单的方法为___。
(2)WO3与Na2CO3溶液反应生成Na2WO4的化学方程式为___。
(3)加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___。
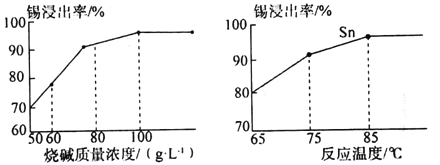
(4)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH的质量浓度和反应时间的关系图,则“碱浸”时最适宜条件为___、___。
(5)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___,将母液返回至浸出液的目的为___。
(6)碱性镀锡以NaOH和Na2SnO3为电解液,以纯锡为阳极材料,待镀金属为阴极材料,镀锡时阳极反应的电极反应式为___。
【答案】+4 用磁铁吸引 Na2CO3+WO3=Na2WO4+CO2↑ 2Sn+3NaOH+NaNO3=2Na2SnO3+NH3↑ 烧碱质量浓度为100g·L-1 反应温度为85℃ 蒸发结晶、趁热过滤(洗涤、干燥) 提高锡酸钠的产率 Sn-4e-+6OH-=SnO32-+3H2O
【解析】
锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,在空气中焙烧,得到As、S的氧化物,焙烧渣加入10%碳酸钠浸出,得到Na2WO4。浸渣加入煤粉焙烧后再加入NaOH、硝酸钠浸出,得到Na2SnO3溶液,经蒸发结晶、趁热过滤得到Na2SnO3晶体。
(1)Na2SnO3中Na为+1价,O为-2价,则锡元素的化合价为+4价;Fe3O4具有磁性,从焙烧渣中除去 Fe3O4最简单的方法为用磁铁吸引;
(2)WO3与Na2CO3溶液反应生成Na2WO4,非氧化还原反应,根据原子守恒配平,化学方程式为Na2CO3+WO3=Na2WO4+CO2↑;
(3)NaNO3的还原产物为NH3,Sn被氧化成Na2SnO3。N的化合价从+5降低到-3,共降低8价,Sn的化合价从0升高到+4价,共升高4价,化合价升降守恒,则Sn和NaNO2的系数比为2:1,根据原子守恒配平化学方程式,则NaNO3氧化Sn的化学方程式为2Sn+3NaOH+NaNO3=2Na2SnO3+NH3↑;
(4)由图可知烧碱质量浓度为100g·L-1,反应温度为85℃时,锡的浸出率最高;
(5)锡酸钠易溶于水,其溶解度随着温度的升高而降低。当温度较高时,锡酸钠会从溶液中析出,因此应该温度较高时过滤,“一系列操作”具体是指蒸发结晶、趁热过滤(洗涤、干燥);母液中含有未沉淀的锡酸钠,将母液返回至浸出液的目的是提高锡酸钠的产率;
(6)阳极发生氧化反应,Sn被氧化生成SnO32-,阳极的反应式为Sn-4e-+6OH-=SnO32-+3H2O。

【题目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) |
|
|
|
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1