题目内容
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
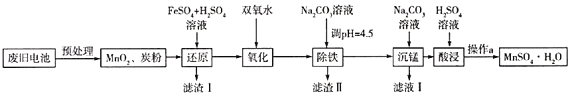
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
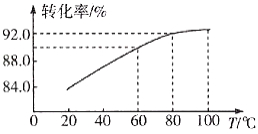
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
【答案】2 4 ×10-21 molL-1 离子键、(极性)共价键 Fe(OH)3 MnO2 +4H++2Fe2+=2Fe3++Mn2++2H2O c 7Na2CO3+7MnSO4+ 11H2O=MnCO36Mn(OH)25H2O↓+7Na2SO4+6CO2↑
【解析】
(3)废旧电池预处理后得到MnO2和炭粉,加入硫酸和硫酸亚铁溶液,二氧化锰具有强氧化性,将亚铁离子氧化成铁离子,得到滤渣I为C,滤液中主要含Fe3+和Mn2+;加入双氧水将过量的亚铁离子氧化,然后加入碳酸钠调节pH值4.5,得到Fe(OH)3沉淀,除去Fe3+,之后再加入碳酸钠溶液进行沉锰得到MnCO36Mn(OH)25H2O,加硫酸溶解得到MnSO4溶液,蒸发浓缩冷却结晶过滤得到硫酸锰晶体。
(1)由题给条件知KMnO4是强酸强碱盐,故HMnO4是强酸,0.01 molL-l的HMnO4溶液的pH=2。
(2)对于反应Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),K=![]() =
=![]() ,当c(Mn2+)=1 ×10-6 molL-1,可求出c(Pb2+)=4 ×10-21 molL-1。
,当c(Mn2+)=1 ×10-6 molL-1,可求出c(Pb2+)=4 ×10-21 molL-1。
(3)①MnSO4是离子化合物,含有离子键,![]() 中含有极性共价键;
中含有极性共价键;
②根据分析可知滤渣Ⅱ主要成分是Fe(OH)3;由流程图知,MnO2被Fe2+还原为Mn2+,Fe2+则被氧化为Fe3+,根据电子守恒和元素守恒可知反应的离子方程式为MnO2 +4H++2Fe2+= 2Fe3+ + Mn2+ +2H2O;由图知当温度达到80 ℃后,MnO2的转化率几乎没有变化,故温度控制在80℃左右为好,再升高温度转化率变化不大,反而浪费资源;
③碳酸根水解显碱性,锰离子水解显酸性,二者相互促进,所以生成的气体应为CO2,故可先写出Na2CO3+MnSO4+ H2O→MnCO36Mn(OH)25H2O↓ +CO2↑,根据质量守恒定律确定有Na2SO4生成,得到7Na2CO3+7MnSO4+11H2O=MnCO36Mn(OH)25H2O↓ +6CO2↑ +7Na2SO4。