题目内容
4.下列反应的离子方程式书写正确的是( )| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
分析 A.NaHS水解生成H2S,且水解程度较小;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.在铁上镀铜,则阳极应该为铜失去电子生成铜离子;
D.铜离子水解生成氢氧化铜和氢离子.
解答 解:A.NaHS水解生成H2S,且水解程度较小,离子方程式为HS-+H2O?OH-+H2S,该方程式为电离方程式,故A错误;
B.离子方程式必须满足电荷守恒,正确离子方程式为:2Fe3++Fe═3Fe2+,故B错误;
C.在铁上镀铜,阳极铜失去电子生成铜离子,正确的电极反应为:Cu-2e-═Cu2+,故C错误;
D.铜离子水解生成氢氧化铜和氢离子,离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,故D正确;
故选D.
点评 本题考查离子方程式正误判断,题目难度中等,侧重考查离子方程式的书写原则,明确物质性质及离子方程式书写规则即可解答,注意多元弱酸根离子、多元弱碱离子水解区别.

练习册系列答案
相关题目
14.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
15.下列各组混合物,只要总质量一定,无论按何种比例混合,完全燃烧后生成C02和H2O的质量都相等的是( )
| A. | C2H2、C2H4 | B. | C6H6,C6H6O | C. | C3H8,C3H6 | D. | CH2O、C2H4O2 |
12.下列说法错误的是( )
| A. | 只要有化学键断裂的变化一定是化学变化 | |
| B. | 并不是所有化学反应的速率都与压强有关 | |
| C. | 可逆反应达到平衡后,正、逆反应速率相等但不为零 | |
| D. | 装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡发生了移动 |
19.工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则常温下,不能与M单质发生反应的是( )
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
9. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Al、Fe、Mg.
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
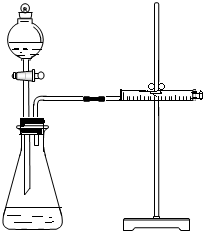
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
13.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
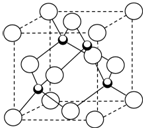 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.