题目内容
14.设NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
分析 A、根据反应后无论生成何种产物,镁元素的化合价均变为+2价来分析;
B、求出重水的物质的量,然后根据1mol重水中含10mol电子来分析;
C、NaHSO4在熔融状态下只能电离出钠离子和HSO4-;
D、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体.
解答 解:A、反应后无论生成何种产物,镁元素的化合价均变为+2价,即1mol镁转移2mol电子,则0.01mol镁转移0.01mol电子,与产物无关,故A正确;
B、18g重水的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水中含10mol电子,故0.9mol重水中含9mol电子即9NA个,故B错误;
C、由于共价键在熔融状态不能断裂,故NaHSO4在熔融状态下只能电离出钠离子和HSO4-,即1molNaHSO4在熔融状态下只能电离出2mol离子即2NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol氯化铁转化得到的氢氧化铁胶粒的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数数的有关计算,掌握公式的应用和物质的结构是解题关键,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
4.工业上生产硫酸时,利用催化氧化反应将二氧化硫转化为三氧化硫是一个关键步骤,在密闭容器中压强及温度对SO2转化率(利用率)的影响如表:
(1)写出二氧化硫转化为三氧化硫的化学方程式2SO2+O2?2SO3. 根据表中数据可知,生成 SO3 的反应属于放热反应(填“放热”或“吸热”. )
(2)在其他条件不变的情况下,扩大容器体积以减小反应体系的压强,v正减小 (填“增大”或“减小”,下同),v逆减小,平衡向逆反应方向移动(选填“正反应”或“逆反应”).
(3)若容器容积为2L,开始加入SO2为0.20mol,10s后测得SO2 的物质的量为0.16mol,则O2的平均反应速率为0.001mol(L•S);若即系通入氧气,则平衡时的SO2转化率增大(选填“增大”或“减小”)
(4)在 400℃~500℃时,SO2 的催化氧化采用常压而不是高压,其主要原因是常压时的转化率较高、高压成本高.
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(2)在其他条件不变的情况下,扩大容器体积以减小反应体系的压强,v正减小 (填“增大”或“减小”,下同),v逆减小,平衡向逆反应方向移动(选填“正反应”或“逆反应”).
(3)若容器容积为2L,开始加入SO2为0.20mol,10s后测得SO2 的物质的量为0.16mol,则O2的平均反应速率为0.001mol(L•S);若即系通入氧气,则平衡时的SO2转化率增大(选填“增大”或“减小”)
(4)在 400℃~500℃时,SO2 的催化氧化采用常压而不是高压,其主要原因是常压时的转化率较高、高压成本高.
19.可逆反应在一定条件下达到化学平衡状态的标志是( )
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
6.汽车尾气中NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体中的血管内又有传送信息的功能,下列有关NO的说法正确的是( )
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
3.下列说法正确的是( )
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
4.下列反应的离子方程式书写正确的是( )
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
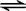 CH3COOH+OH-;
CH3COOH+OH-;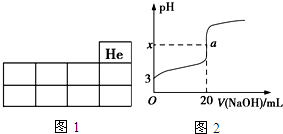 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;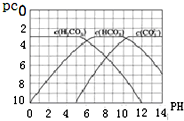 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.