题目内容
12.下列说法错误的是( )| A. | 只要有化学键断裂的变化一定是化学变化 | |
| B. | 并不是所有化学反应的速率都与压强有关 | |
| C. | 可逆反应达到平衡后,正、逆反应速率相等但不为零 | |
| D. | 装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡发生了移动 |
分析 A.化学反应的实质为旧键断裂、新键形成;
B.固体之间的反应与压强无关;
C.可逆反应达到平衡后,正、逆反应速率相等但不为零;
D.装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡向生成NO2的方向移动.
解答 解:A.化学反应的实质为旧键断裂、新键形成,则既有化学键断裂又有化学键形成的变化一定是化学变化,故A错误;
B.固体之间的反应与压强无关,故B正确;
C.可逆反应达到平衡后,正、逆反应速率相等但不为零,故C正确;
D.装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡向生成NO2的方向移动,故D正确;
故选A.
点评 本题考查较综合,涉及反应速率、化学反应与化学键、平衡移动等,为高考常见题型,把握常见的实例为解答的关键,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
3.下列说法正确的是( )
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
20.下列关于晶体结构的说法不正确的是( )


| A. | 在NaCl晶体中,距Na+最近的Cl-有6个 | |
| B. | 在NaCl晶体中,每个晶胞实际拥有4个Na+、4个Cl- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的数目比为1:4 | |
| D. | 在金刚石晶体中,最小环是由6个碳原子构成 |
7.铊元素位于元素周期表第6周期ⅢA族.下面关于铊元素性质的说法不正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
17.一定温度下,在容积为2L的密闭容器中进行反应:aM(气)?bN(气).M、N的物质的量随时间的变化如图所示,下列表述中正确的是( )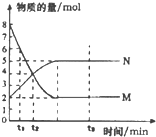

| A. | 反应式中a:b=2:5 | |
| B. | 0-t1物质M的浓度c(M)减少了1mol•L-1 | |
| C. | t2时,c(M)=c(N)=4mol•L-1,反应一定达到平衡状态 | |
| D. | t3时,c(M)不再变化,正反应速率小于逆反应速率 |
4.下列反应的离子方程式书写正确的是( )
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
1.硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计如图实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来.
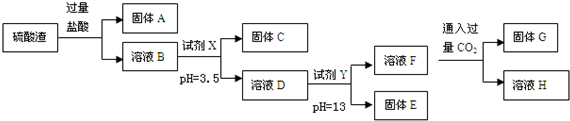
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
(1)固体A的化学式为SiO2.
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)

已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)
2. X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;