题目内容
共价键具有饱和性和方向性.下列有关共价键的这两个特征的叙述中,不正确的是( )
| A、共价键的饱和性是由成键原子的未成对电子数决定的 |
| B、共价键的方向性是由成键原子的轨道的方向决定的 |
| C、共价键的饱和性与原子轨道的重叠程度有关 |
| D、共价键的方向性决定了分子的立体构型 |
考点:共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:一般的,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了;
形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,这种成键的方向性也就决定了所形成分子的构型.
形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,这种成键的方向性也就决定了所形成分子的构型.
解答:
解:一般的,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了,故原子的未成对电子数目决定了该原子形成的共价键具有饱和性,这一饱和性也就决定了该原子成键时最多连接的原子数,故A正确;形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,这种成键的方向性也就决定了所形成分子的构型,故B、D正确.所以C错误;
故选C.
故选C.
点评:本题主要考查了共价键饱和性和方向性的决定因素,难度不大,注意对应知识的掌握.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A、对混合溶液进行微热,K1增大、K2减小 |
| B、混合溶液的pH<7 |
| C、混合溶液中c(CH3COO-)>c(Na+) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
关于实验室制取乙烯的实验,下列说法正确的是( )
| A、所用的反应药品为1体积酒精和3体积浓度为5mol/L的硫酸 |
| B、反应容器(烧瓶)中应加入少许碎瓷片 |
| C、温度计要插入反应液体的液面下,以控制温度在140℃ |
| D、收集乙烯可用排水法,也可用排空气法 |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、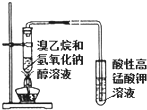 用此装置可以验证溴乙烷发生了消去反应 |
B、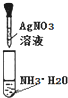 用此装置配制银氨溶液 |
C、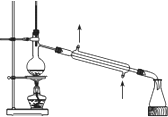 用装置提纯工业乙醇 |
D、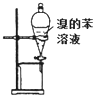 用装置萃取溴水中的溴,并把溴的苯溶液从下口放出 |
下列水溶液一定呈中性的是( )
| A、c(NH4+)=c(Cl-)的NH4Cl溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=7的溶液 |
| D、室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
既有氧化性、又有还原性的物质是( )
| A、SO2 |
| B、SO3 |
| C、Na |
| D、Fe3+ |
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g)═2Z(g),并达到平衡.已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
| A、若X的反应速率为0.2 mol?L-1?s-1,则Z的反应速率为0.3 mol?L-1?s-1 |
| B、若向容器中充入氦气,压强增大,Y的转化率提高 |
| C、升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D、开始充入容器中的X、Y物质的量之比为2:1 |
如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )
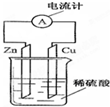

| A、负极反应式为:Zn-2e-═Zn2+ |
| B、正极反应式为:2H++2e-═H2↑ |
| C、电子由锌片通过导线流向铜片,再由铜片经电解质溶液流回锌片 |
| D、该装置能将化学能转变为电能 |