题目内容
下列水溶液一定呈中性的是( )
| A、c(NH4+)=c(Cl-)的NH4Cl溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=7的溶液 |
| D、室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
考点:水的电离,溶液pH的定义
专题:电离平衡与溶液的pH专题
分析:溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断,
当c(H+)>c(OH-),溶液就呈酸性;
当c(H+)=c(OH-),溶液就呈中性;
当溶液中c(H+)<c(OH-),溶液就呈碱性;
注意不能根据溶液的pH值大小判断.
当c(H+)>c(OH-),溶液就呈酸性;
当c(H+)=c(OH-),溶液就呈中性;
当溶液中c(H+)<c(OH-),溶液就呈碱性;
注意不能根据溶液的pH值大小判断.
解答:
解:溶液的酸碱性与溶液中H+浓度与OH-浓度的相对大小有关,当c(H+)=c(OH-),溶液就呈中性,
A、溶液存在的离子有:NH+4、H+、Cl-、OH-,溶液呈电中性,所以电荷守恒:c(NH+4)+c(H+)=c(Cl-)+c(OH-),因为c(NH+4)=c(Cl-),所以,c(H+)=c(OH-),溶液呈中性,故A正确;
B、c(H+)=10-7mol?L-1的溶液,溶液的pH=7,如A所分析,溶液不一定成中性,故B错误;
C、pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,则溶液中c(H+)、c(OH-)不一定相等,故C错误;
D、没有告诉为酸碱的强弱,无法计算溶液中氢离子和氢氧根离子浓度,无法判断反应后溶液中H+浓度与OH-浓度的相对大小,故D错误;
故选C.
A、溶液存在的离子有:NH+4、H+、Cl-、OH-,溶液呈电中性,所以电荷守恒:c(NH+4)+c(H+)=c(Cl-)+c(OH-),因为c(NH+4)=c(Cl-),所以,c(H+)=c(OH-),溶液呈中性,故A正确;
B、c(H+)=10-7mol?L-1的溶液,溶液的pH=7,如A所分析,溶液不一定成中性,故B错误;
C、pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,则溶液中c(H+)、c(OH-)不一定相等,故C错误;
D、没有告诉为酸碱的强弱,无法计算溶液中氢离子和氢氧根离子浓度,无法判断反应后溶液中H+浓度与OH-浓度的相对大小,故D错误;
故选C.
点评:本题考查了水的电离及溶液酸碱性的判断,题目难度不大,注意溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,不能直接用溶液的pH判断.

练习册系列答案
相关题目
某种有机物如图所示,有关该物质的说法正确的是( )
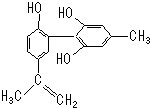

| A、由于酚酸性比碳酸弱,故此物质不可能与碳酸钠溶液反应 |
| B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4mol、7mol |
| D、该分子中的所有原子可能共平面 |
下列有机物的名称正确的是( )
| A、1,2-二甲基丁烷 |
| B、2,3-二甲基丁烷 |
| C、3,3-二甲基丁烷 |
| D、2-乙基丙烷 |
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中进行,下列是四种不同条件下的反应速率,其中化学反应速率最快的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列物质属于纯净物的是( )
| A、空气 | B、碱石灰 | C、液氯 | D、海水 |
共价键具有饱和性和方向性.下列有关共价键的这两个特征的叙述中,不正确的是( )
| A、共价键的饱和性是由成键原子的未成对电子数决定的 |
| B、共价键的方向性是由成键原子的轨道的方向决定的 |
| C、共价键的饱和性与原子轨道的重叠程度有关 |
| D、共价键的方向性决定了分子的立体构型 |
下列各组物质互为同系物的是( )
| A、金刚石和石墨 |
B、CH3-CH2-CH2-CH3和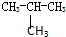 |
| C、CH4和C2H6 |
| D、16O和18O |
下列措施能减慢化学反应速率的是( )
| A、将煤块粉碎后燃烧 |
| B、用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气 |
| C、用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D、将食物贮藏在冰箱中 |