题目内容
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A、对混合溶液进行微热,K1增大、K2减小 |
| B、混合溶液的pH<7 |
| C、混合溶液中c(CH3COO-)>c(Na+) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.电离、水解均为吸热反应;
B.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性;
C.根据醋酸和醋酸钠的混合溶液中,电离程度大于水解程度,判断离子浓度关系;
D.温度不变,若在混合溶液中加入少量NaOH固体,促电离抑水解c(CH3COO-)增大.
B.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性;
C.根据醋酸和醋酸钠的混合溶液中,电离程度大于水解程度,判断离子浓度关系;
D.温度不变,若在混合溶液中加入少量NaOH固体,促电离抑水解c(CH3COO-)增大.
解答:
解:A.电离、水解均为吸热反应,所以对混合溶液进行微热,K1增大、K2增大,故A错误;
B.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性,故B正确;
C.根据醋酸和醋酸钠的混合溶液中,电离程度大于水解程度,所以混合溶液中c(CH3COO-)>c(Na+),故C正确;
D.温度不变,若在混合溶液中加入少量NaOH固体,促电离抑水解c(CH3COO-)增大,故D错误;故选BC.
B.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性,故B正确;
C.根据醋酸和醋酸钠的混合溶液中,电离程度大于水解程度,所以混合溶液中c(CH3COO-)>c(Na+),故C正确;
D.温度不变,若在混合溶液中加入少量NaOH固体,促电离抑水解c(CH3COO-)增大,故D错误;故选BC.
点评:本题考查弱电解质的电离及盐类水解,明确电离与水解的程度及K的影响因素即可解答,题目难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
下列各组元素原子中,按金属性依次增强或非金属性依次减弱的是( )
| A、Na,Mg,Al |
| B、N,O,F |
| C、Li,Na,K |
| D、Cl,I,Br |
下列说法正确的是( )
| A、晶体的分子间作用力越大,分子越稳定 |
| B、HCl气体和NaCl固体分别溶于水形成溶液的过程中均破坏了化学键 |
| C、其水溶液能导电的化合物一定是离子化合物 |
| D、由非金属元素组成的化合物一定是共价化合物 |
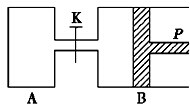 如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.下列说法错误的是( )
如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.下列说法错误的是( )| A、B中X的转化率为75% |
| B、A中X的转化率比B中的低 |
| C、平衡时A中混合气体密度比B小 |
| D、打开K,一段时间后反应再次达到平衡,则B的体积为1.2a L |
某种有机物如图所示,有关该物质的说法正确的是( )
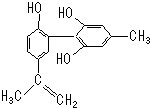

| A、由于酚酸性比碳酸弱,故此物质不可能与碳酸钠溶液反应 |
| B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4mol、7mol |
| D、该分子中的所有原子可能共平面 |
下列有关NH3的性质特点,描述错误的是( )
| A、极易溶于水,可与水做喷泉实验 |
| B、液氨能作制冷剂 |
| C、工业上常用氮气和氢气合成氨气 |
| D、常温下是无色无味气体,密度比空气小 |
下列变化中,由氧化反应引起的是( )
| A、乙烯通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 |
| B、在一定条件下,苯与氢气反应生成环己烷 |
| C、在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 |
| D、在催化剂作用下,乙烯分子间发生加成聚合反应生成高分子聚乙烯 |
现有六种物质:铁粉、NaOH溶液、Ba(NO3)2溶液、稀硫酸、Fe2O3和CuSO4溶液,将它们两两混合后,能发生的化学反应共有( )
| A、7个 | B、6个 | C、5个 | D、4个 |
共价键具有饱和性和方向性.下列有关共价键的这两个特征的叙述中,不正确的是( )
| A、共价键的饱和性是由成键原子的未成对电子数决定的 |
| B、共价键的方向性是由成键原子的轨道的方向决定的 |
| C、共价键的饱和性与原子轨道的重叠程度有关 |
| D、共价键的方向性决定了分子的立体构型 |