题目内容
如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )
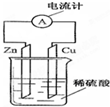

| A、负极反应式为:Zn-2e-═Zn2+ |
| B、正极反应式为:2H++2e-═H2↑ |
| C、电子由锌片通过导线流向铜片,再由铜片经电解质溶液流回锌片 |
| D、该装置能将化学能转变为电能 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,锌易失电子作负极,电极反应式为Zn-2e-═Zn2+,铜作正极,电极反应为2H++2e-═H2↑,电子从负极沿导线流向正极.
解答:
解:A.该装置中,锌失电子发生氧化反应而作负极,电极反应式为Zn-2e-═Zn2+,故A正确;
B.铜作正极,正极是上氢离子放电,电极反应为2H++2e-═H2↑,故B正确;
C.电子从负极锌沿导线流向正极Cu,电子不进入电解质溶液,故C错误;
D.该装置是将化学能转化为电能的装置,为原电池,故D正确;
故选C.
B.铜作正极,正极是上氢离子放电,电极反应为2H++2e-═H2↑,故B正确;
C.电子从负极锌沿导线流向正极Cu,电子不进入电解质溶液,故C错误;
D.该装置是将化学能转化为电能的装置,为原电池,故D正确;
故选C.
点评:本题考查了原电池原理,根据金属失电子难易程度确定正负极,知道正负极上发生的电极反应,易错选项是C,注意电子不进入电解质溶液,电解质溶液中通过离子的定向移动形成电流,为易错点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
现有六种物质:铁粉、NaOH溶液、Ba(NO3)2溶液、稀硫酸、Fe2O3和CuSO4溶液,将它们两两混合后,能发生的化学反应共有( )
| A、7个 | B、6个 | C、5个 | D、4个 |
共价键具有饱和性和方向性.下列有关共价键的这两个特征的叙述中,不正确的是( )
| A、共价键的饱和性是由成键原子的未成对电子数决定的 |
| B、共价键的方向性是由成键原子的轨道的方向决定的 |
| C、共价键的饱和性与原子轨道的重叠程度有关 |
| D、共价键的方向性决定了分子的立体构型 |
已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 放出Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A、Q3+92.4c1=92.4 |
| B、α2+α3<1 |
| C、2p1=2p3<p2 |
| D、达到平衡时丙容器中NH3的体积分数最大 |
下列措施能减慢化学反应速率的是( )
| A、将煤块粉碎后燃烧 |
| B、用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气 |
| C、用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D、将食物贮藏在冰箱中 |
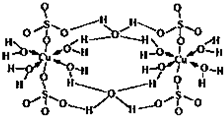 胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:下列说法正确的是 ( )
胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:下列说法正确的是 ( )| A、在上述物质的溶液中滴加BaCl2溶液无现象 |
| B、在上述结构示意图中,存在配位键、共价键和离子键 |
| C、胆矾是分子晶体,分子间存在氢键 |
| D、胆矾中的结晶水在不同温度下会逐渐失去 |
在元素周期表中金属元素和非金属元素分界线附近,容易找到的元素是( )
| A、耐高温的合金材料 |
| B、制农药的元素 |
| C、作半导体材料的元素 |
| D、作催化剂的元素 |
下列一定属于不饱和烃的是( )
| A、C2H4 |
| B、C4H8 |
| C、C3H8 |
| D、C5H12 |