题目内容
7.由下列实验现象得出的结论正确的是( )| 选项 | 实验现象 | 结论 |
| A | 取某Na2SO3溶液,加入足量的稀盐酸,产生气泡,再滴加BaCl2溶液,产生白色沉淀. | Na2SO3已部分被氧化 |
| B | 向2mL0.1mol/LNaOH溶液中滴加0.1mol/LMgCl2溶液3滴,出现白色沉淀后,再滴加3滴0.1mol/L FeCl3溶液,出现红褐色沉淀. | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 向氯水中通入足量SO2,氯水褪色. | SO2具有漂白性 |
| D | 相同温度下,测等浓度的Na2CO3和Na2SO3水溶液的pH:pH (Na2CO3)>pH(Na2SO3). | 非金属性强弱:C>S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入足量的稀盐酸,排除亚硫酸根离子的干扰,再滴加BaCl2溶液,产生白色沉淀为硫酸钡;
B.NaOH过量,均为沉淀的生成,不发生沉淀的转化;
C.氯水中通入足量SO2,发生氧化还原反应生成硫酸和盐酸;
D.Na2SO3对应的酸不是最高价含氧酸,不能比较非金属性.
解答 解:A.加入足量的稀盐酸,排除亚硫酸根离子的干扰,再滴加BaCl2溶液,产生白色沉淀为硫酸钡,可知Na2SO3已部分被氧化,混有硫酸钠,故A正确;
B.NaOH过量,均为沉淀的生成,不发生沉淀的转化,则不能比较Mg(OH)2、Fe(OH)3的溶解度,故B错误;
C.氯水中通入足量SO2,发生氧化还原反应生成硫酸和盐酸,与二氧化硫的还原性有关,与其漂白性无关,故C错误;
D.Na2SO3对应的酸不是最高价含氧酸,不能比较非金属性,应测定等浓度的Na2CO3和Na2SO4水溶液的pH:pH (Na2CO3)>pH(Na2SO4)比较C、S的非金属性,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、沉淀的生成、盐类水解及非金属性比较等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列物质不能通过化合反应而得到的是( )
| A. | NO2 | B. | Fe(OH)3 | C. | FeCl2 | D. | H2SiO3 |
15.化学与生化、社会密切相关,下列说法不正确的是( )
| A. | 维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高 | |
| B. | 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求 | |
| C. | 稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的 | |
| D. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
2.化学与生活、社会密切相关,下列说法错误的是( )
| A. | 玻璃属于无机非金属材料 | B. | 煤的气化属于物理变化 | ||
| C. | 雾霾与汽车尾气的排放有关 | D. | 甲醛的水溶液可以用来浸泡标本 |
12.下列有关化学用语表示正确的是( )
| A. | 氟原子的结构示意图: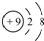 | |
| B. | 邻硝基甲苯的结构简式: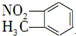 | |
| C. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co | |
| D. | H2O2的电子式: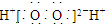 |
19.下列图示与对应的叙述相符的是( )


| A. | 图1表示相同温度下,相同体积、pH均为1的盐酸和醋酸溶液分别加水稀释时溶液pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化 | |
| C. | 图3表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应 | |
| D. | 图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)???N2O4(g),相同时间后测得NO2体积分数的曲线,则该反应的正反应△H<0 |
17.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | KAl(SO4)2溶液:c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| B. | 用酚酞作指示剂,向氨水中滴入标准盐酸至滴定终点:c(NH4+)<c(Cl-) | |
| C. | NH4Cl与Ba(NO3)2的混合溶液:c(Cl-)+2c(NO3-)=c(NH4+)+c(NH3•H2O)+c(Ba2+) | |
| D. | 饱和氯水中:c(H+)=2c(ClO-)+c(HClO)+c(OH-) |
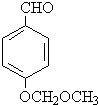 .
.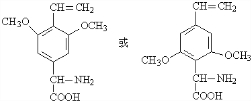 (任写一种).
(任写一种).