题目内容
11.下列物质不能通过化合反应而得到的是( )| A. | NO2 | B. | Fe(OH)3 | C. | FeCl2 | D. | H2SiO3 |
分析 A.NO与氧气发生化合反应;
B.氢氧化亚铁、氧气、水可发生化合反应;
C.Fe与氯化铁发生化合反应;
D.二氧化硅不溶于水,与水不反应.
解答 解:A.NO与氧气发生化合反应生成NO2,故A不选;
B.氢氧化亚铁、氧气、水可发生化合反应生成Fe(OH)3,故B不选;
C.Fe与氯化铁发生化合反应生成FeCl2,故C不选;
D.二氧化硅不溶于水,与水不反应,则不能利用化合反应生成H2SiO3,故D选;
故选D.
点评 本题考查元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意化合反应的特点,题目难度不大.

练习册系列答案
相关题目
1.下列有关碱金属元素的性质,从上到下递变规律正确的是( )
| A. | 金属性逐渐减弱 | |
| B. | 熔点依次升高 | |
| C. | 失电子能力逐渐增强 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
2.有下列两组命题
B组中命题正确,且能用A组命题加以正确解释的是( )
| A组 | B组 |
| Ⅰ.H-F键键能小于H-Cl键键能 | ①HCl比HF稳定 |
| Ⅱ.H-I键键能小于H-Cl键键能 | ②HCl比HI稳定 |
| Ⅲ.HCl分子间作用力大于HF分子间作用力 | ③HCl沸点比HF高 |
| Ⅳ.HI分子间作用力小于HCl分子间作用力 | ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
19.下列关于Li、Na、K、Rb、Cs碱金属元素的性质比较中,与事实不完全相符合的是( )
| A. | 原子半径依次增大 | B. | 离子半径依次增大 | ||
| C. | 单质的密度依次逐渐增大 | D. | 氢氧化物的碱性依次增强 |
6.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式 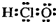 | |
| B. | S2-的结构示意图: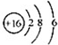 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | NH4I的电子式: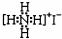 |
16.关于元素周期表中的16号元素的说法正确的是( )
| A. | 最高正价是+5价 | B. | 最低负价为-2价 | ||
| C. | 该元素位于第二周期 | D. | 该元素属于ⅤA族元素 |
3.经测定,由C3H7OH、C2H5OC2H5和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数为( )
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
6.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为SO2+MnO2═Mn2++SO42-;
(2)第1步除杂中加入H2O2的目的是将Fe2+氧化为Fe3+.
(3)第1步除杂中形成滤渣l的主要成分为Al(OH)3、Fe(OH)3(填化学式),调pH至5-6所加的试剂,可选择a、b(填以下试剂的序号字母); a.Cao b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+═Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是因为减少MnSO4•H2O在水中的溶解,得到更所得产品.
(6)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++2H2O?Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的PH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为SO2+MnO2═Mn2++SO42-;
(2)第1步除杂中加入H2O2的目的是将Fe2+氧化为Fe3+.
(3)第1步除杂中形成滤渣l的主要成分为Al(OH)3、Fe(OH)3(填化学式),调pH至5-6所加的试剂,可选择a、b(填以下试剂的序号字母); a.Cao b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+═Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是因为减少MnSO4•H2O在水中的溶解,得到更所得产品.
(6)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++2H2O?Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).
7.由下列实验现象得出的结论正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 取某Na2SO3溶液,加入足量的稀盐酸,产生气泡,再滴加BaCl2溶液,产生白色沉淀. | Na2SO3已部分被氧化 |
| B | 向2mL0.1mol/LNaOH溶液中滴加0.1mol/LMgCl2溶液3滴,出现白色沉淀后,再滴加3滴0.1mol/L FeCl3溶液,出现红褐色沉淀. | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 向氯水中通入足量SO2,氯水褪色. | SO2具有漂白性 |
| D | 相同温度下,测等浓度的Na2CO3和Na2SO3水溶液的pH:pH (Na2CO3)>pH(Na2SO3). | 非金属性强弱:C>S |
| A. | A | B. | B | C. | C | D. | D |