题目内容
12.下列有关化学用语表示正确的是( )| A. | 氟原子的结构示意图: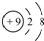 | |
| B. | 邻硝基甲苯的结构简式: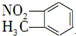 | |
| C. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co | |
| D. | H2O2的电子式: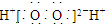 |
分析 A.F原子的质子数=核外电子数=9,最外层为7个电子;
B.硝基的书写错误,硝基写在苯环左边应该表示为:O2N-;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.过氧化氢为共价化合物,分子中不存在阴阳离子.
解答 解:A.氟原子核电荷数、核外电子总数都是9,氟原子正确的结构示意图为: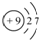 ,故A错误;
,故A错误;
B.硝基的N原子与苯环相连,邻硝基甲苯正确的结构简式为: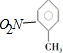 ,故B错误;
,故B错误;
C.质子数为27、中子数为33的Co原子的质量数为60,该原子可以表示为:${\;}_{27}^{60}$Co,故C正确;
D.双氧水为共价化合物,其分子中存在两个氧氢键和1个氧氧键,其正确的电子式为: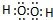 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、元素符号、结构简式、原子结构示意图等化学用语的概念及书写原则,明确离子化合物与共价化合物电子式的区别,B为易错点,注意硝基的连接方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.关于元素周期表中的16号元素的说法正确的是( )
| A. | 最高正价是+5价 | B. | 最低负价为-2价 | ||
| C. | 该元素位于第二周期 | D. | 该元素属于ⅤA族元素 |
3.下列实验装置或操作设计正确且能达到实验目的是( )
| A. |  称量NaOH固体 | B. |  配制一定物质的量浓度稀硫酸 | ||
| C. |  制取少量的Fe(OH)3胶体 | D. |  用H2SO4标准溶液滴定NaOH溶液 |
20.已知A、B、C、D、E是短周期中原子序数依次增大的5中主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |
7.由下列实验现象得出的结论正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 取某Na2SO3溶液,加入足量的稀盐酸,产生气泡,再滴加BaCl2溶液,产生白色沉淀. | Na2SO3已部分被氧化 |
| B | 向2mL0.1mol/LNaOH溶液中滴加0.1mol/LMgCl2溶液3滴,出现白色沉淀后,再滴加3滴0.1mol/L FeCl3溶液,出现红褐色沉淀. | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 向氯水中通入足量SO2,氯水褪色. | SO2具有漂白性 |
| D | 相同温度下,测等浓度的Na2CO3和Na2SO3水溶液的pH:pH (Na2CO3)>pH(Na2SO3). | 非金属性强弱:C>S |
| A. | A | B. | B | C. | C | D. | D |
17.X、Y、Z、M、W为五种短周期元素.X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示.下列说法不正确的是( )
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
1.化学与生产、生活、环境密切相关.下列说法中,不正确的是( )
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| C. | 氢氧化铝可用于制作治疗胃酸过多的药物 | |
| D. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 |
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | pH=12的溶液K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:K+、NH4+、HCO3-、Cl- | |
| D. | 酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
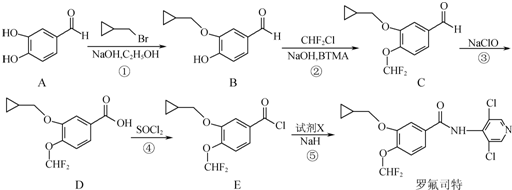
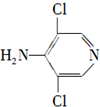 .
.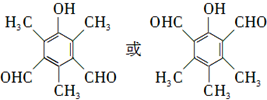 等.
等.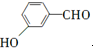 、CH3CH2OH为原料制备
、CH3CH2OH为原料制备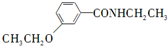 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: