题目内容
1.下列说法正确的是( )| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
分析 A.3p2表示3p能级有两个电子;
B.处于最低能量状态的原子叫做基态原子;
C.不同能层中的相同能级,能层越高能量越大;
D.不同能层中的相同能级,含有相同的轨道.
解答 解:A.3p2表示3p能级有两个电子,3p能级有3个轨道,故A错误;
B.处于最低能量状态的原子叫做基态原子,故B正确;
C.同一原子中,1s、2s、3s轨道的能量逐渐增大,故C错误;
D.同一原子中,2p、3p能级都含有3个轨道,没有1p,故D错误;
故选B.
点评 本题考查原子构造原理,比较基础,旨在考查学生对基础知识的理解掌握,注意掌握构造原理.

练习册系列答案
相关题目
11.已知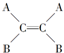 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
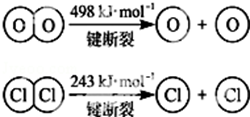
12.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.

9.钠硫电池属于温绿色二次电流,用液态钠、硫和多硫化钠作电极,以能传导钠离子的固体氧化铝作电解质.电池反应为:2Na+xS$?_{充电}^{放电}$Na2Sx.下列有关说法正确的是( )
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
5.几种短周期元素的原子半径和主要化合价见表,下列有关说法中,正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| C. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| D. | 与稀盐酸反应的剧烈程度:M单质<X单质 |
 一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: