题目内容
13. 一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:试验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18g,澄清石灰水变浑浊后又恰好变澄清.请根据实验回答下列问题:
(1)O2要过量的原因是把有机物蒸气完全带入反应装置,保证有机物完全燃烧,从反应装置中把H2O(g)和CO2完全赶出.
(2)若该有机物只含C、H两种元素,且不含任何官能团,但含苯环,则该有机物的分子式为C8H10,它可能属于苯的同系物、芳香烃.
分析 (1)该反应需要通过测量燃烧产物二氧化碳、水的量确定其分子式,所以需要通入过量氧气,确保有机物完全燃烧,且利用氧气将燃烧产物赶出,据此进行解答;
(2)根据n=$\frac{V}{{V}_{m}}$计算出该有机物的物质的量,干燥管和洗气瓶共增重18g,根据n=$\frac{m}{M}$计算出水的物质的量,再利用质量守恒定律确定有机物分子中含有H原子数;澄清石灰水吸收二氧化碳,变浑浊后又恰好变澄清,说明反应生成碳酸氢钙,根据氢氧化钙的物质的量计算出消耗二氧化碳的物质的量,再计算出该有机物分子中含有的C原子数,从而确定该有机物的分子式;根据该有机物含有苯环,不含其它官能团判断该有机物类型.
解答 解:(1)试验过程中,为了把有机物蒸气完全带入反应装置,保证有机物完全燃烧,从反应装置中把H2O(g)和CO2完全赶出,所以通入的氧气需要足量,
故答案为:把有机物蒸气完全带入反应装置,保证有机物完全燃烧,从反应装置中把H2O(g)和CO2完全赶出;
(2)标准状况下4.48L气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
无水CuSO4变蓝,干燥管和洗气瓶共增重18g,说明18g为水的质量,则水的物质的量为:$\frac{18g}{18g/mol}$=1mol,该有机物分子中含有H原子数为:$\frac{1mol×2}{0.2mol}$=10,
含0.8mol Ca(OH)2的澄清石灰水变浑浊又变澄清,说明二氧化碳与氢氧化钙反应生成碳酸氢钙,则生成二氧化碳的物质的量为:0.8mol×2=1.6mol,该有机物分子中含有C原子数为:$\frac{1.6mol}{0.2mol}$=8,
该有机物只含C、H元素,则该有机物分子式为:C8H10,该有机物不含任何官能团,但含苯环,则该有机物属于苯的同系物、芳香烃,
故答案为:C8H10;苯的同系物、芳香烃.
点评 本题考查了有机物分子式的确定,题目难度中等,明确质量守恒定律在确定有机物分子式中的应用,注意掌握常见有机物结构、性质及分类方法.

 阅读快车系列答案
阅读快车系列答案 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:⑤
 ;⑪
;⑪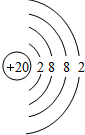 .
.(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
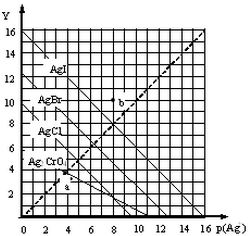 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
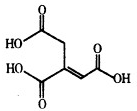 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )| A. | 乌头酸与醋酸是同系物 | |
| B. | 乌头酸中碳元素的质量分数为41.4% | |
| C. | 乌头酸能发生中和反应、水解反应、酯化反应 | |
| D. | 含1mol乌头酸的溶液最多可消耗3mol NaOH、3mol Br2 |
 .其基态原子有26种能量不同的电子;
.其基态原子有26种能量不同的电子;