题目内容
4.如图是某大型化工生产的工艺流程图(部分反应物或生成物已经略去):
请回答下列问题:
(1)流程中所涉及的化学工业有:合成氨、硝酸制备联合制碱法(或侯式制碱法).
(2)工业从液态空气中分离出A、B利用的原理是根据沸点不同进行分离.
(3)图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是通入过量的空气,一氧化氮循环使用.
(4)工业生产反应Ⅰ的方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3,为提高原料转化率的反应条件是高压,生产中需将产物液化分离的目的是降低生成物浓度,使平衡正向移动,提高原料的利用率.
(5)写出反应Ⅱ的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)图示中生成小苏打的化学方程式NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,母液与K分离的方法是过滤.有两种方案从母液中获得副产品J:①通入氨气、冷却、加食盐、过滤②不通氨气、冷却、加食盐、过滤对比这两种方案.方案①通入氨气的作用增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯;方案①滤液一般不能反复循环利用,其原因是滤液中碳酸根离子浓度增大,最终影响副产品的纯度.
分析 流程分析可知,液态空气蒸馏得到A、B为O2和N2,焦炭和水高温反应生成C、D为H2和CO,B和C能反应生成E,是工业生产中的反应,则应为合成氨的反应,则E为NH3,进一步推得A为O2,B为N2,C为H2,D为CO,CO和H2O反应生成氢气和二氧化碳,所以F为CO2,A+E=G,是氨气和氧气反应生成一氧化氮和水,G为NO,H为NO2,I为HNO3,硝酸和氨气反应生成L是NH4NO3,氨气、二氧化碳和饱和氯化钠溶液反应生成碳酸氢钠沉淀和氯化铵,所以K为NaHCO3,M为Na2CO3,母液为NH4Cl,加入氯化钠析出氯化铵晶体J,据此答题.
解答 解:流程分析可知,液态空气蒸馏得到A、B为O2和N2,焦炭和水高温反应生成C、D为H2和CO,B和C能反应生成E,是工业生产中的反应,则应为合成氨的反应,则E为NH3,进一步推得A为O2,B为N2,C为H2,D为CO,CO和H2O反应生成氢气和二氧化碳,所以F为CO2,A+E=G,是氨气和氧气反应生成一氧化氮和水,G为NO,H为NO2,I为HNO3,硝酸和氨气反应生成L是NH4NO3,氨气、二氧化碳和饱和氯化钠溶液反应生成碳酸氢钠沉淀和氯化铵,所以K为NaHCO3,M为Na2CO3,母液为NH4Cl,加入氯化钠析出氯化铵晶体J,
(1)流程中设计到的工业制备有工业合成氨、硝酸制备,联合制碱,
故答案为:硝酸制备;
(2)利用氮气和氧气的沸点不同通过蒸馏方法控制温度分离得到氮气和氧气,
故答案为:根据沸点不同进行分离;
(3)通入过量的空气,过程中生成的一氧化氮循环使用,可以提高一氧化氮的利用率和减少污染,
故答案为:通入过量的空气,一氧化氮循环使用;
(4)工业生产反应Ⅰ是氮气和氢气高温高压催化剂反应生成氨气,反应方程式为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,提高原料转化率,应使平衡正向进行,可以增大压强,所以提高原料转化率的反应条件是高压,生产中需将产物液化分离可以降低生成物浓度,使平衡正向移动,提高原料的利用率,
故答案为:N2+3H2$?_{催化剂}^{高温高压}$2NH3;高压;降低生成物浓度,使平衡正向移动,提高原料的利用率;
(5)反应Ⅱ是氨气的催化氧化反应生成一氧化氮和水,反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(6)是向氨化的饱和食盐水中通入二氧化碳气体发生反应生成碳酸氢钠和氯化铵,反应方程式为NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,母液与碳酸氢钠分离的方法是过滤,从母液中获得副产品NH4Cl:通入氨气、冷却、加食盐、过滤,通入氨气的作用是增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯,由于滤液中碳酸根离子浓度增大,最终影响副产品的纯度,所以滤液一般不能反复循环利用,
故答案为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;过滤;增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯;滤液中碳酸根离子浓度增大,最终影响副产品的纯度;
点评 本题考查无机物推断,涉及常见的化工生产的原理,需要学生熟练掌握元素化合物知识,注意根据图中转化关系进行推断,难度较大.

| A. | 水 | B. | 溴水 | C. | FeCl3溶液 | D. | 银氨溶液 |
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
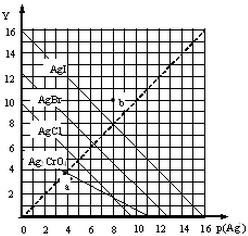 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
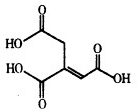 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )| A. | 乌头酸与醋酸是同系物 | |
| B. | 乌头酸中碳元素的质量分数为41.4% | |
| C. | 乌头酸能发生中和反应、水解反应、酯化反应 | |
| D. | 含1mol乌头酸的溶液最多可消耗3mol NaOH、3mol Br2 |
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
 的合成方法有:
的合成方法有: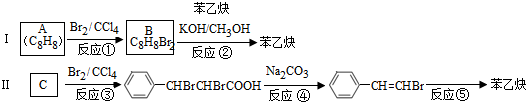
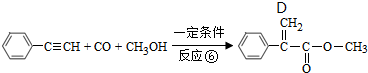
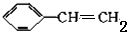 ,反应①,②涉及的反应类型是加成反应、消去反应.
,反应①,②涉及的反应类型是加成反应、消去反应.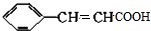 ,反应⑤的化学方程式为
,反应⑤的化学方程式为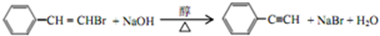 (注明反应条件)
(注明反应条件)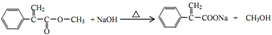 .
.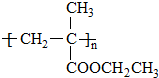 单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为
单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为 .
.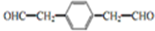 .
. .其基态原子有26种能量不同的电子;
.其基态原子有26种能量不同的电子;