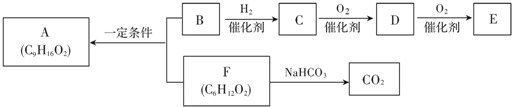
题目内容
11.已知 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 首先依据丙烯中所含有的化学环境不同的H的个数确定其一氯代物的结构简式,然后找出这些一氯代物是否存在顺反异构即可.
解答 解:丙烯中含有3种不同的H,故其一氯代物有3种,分别为:CHCl=CH-CH3、CH2=CClCH3和CH2=CH-CH2Cl,其中CHCl=CH-CH3存在顺反异构,CH2=CClCH3和CH2=CH-CH2Cl均不存在顺反异构,故总共一氯丙烯的同分异构体有4种,故选B.
点评 本题考查学生有机物的同分异构体的书写知识,可以根据教材知识来回答,难度不大,注意解题方法的掌握可以节省解题时间.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
2.已知在100℃的温度下,水的离子积KW=1×10-12(本题涉及的溶液温度均为100℃)下列说法正确的是( )
| A. | 0.05 mol•L-1的H2SO4溶液pH=1 | |
| B. | 0.001 mol•L-1的NaOH溶液pH=11 | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL |
19.将反应Zn+CuSO4═ZnSO4+Cu设计成原电池.下列判断不正确的是( )
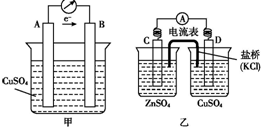

| A. | 若设计成图甲所示的原电池,电极A、B分别是Zn、Cu | |
| B. | 若设计成图乙所示的原电池,D电极反应式为:Cu2++2e-═Cu | |
| C. | 原电池乙工作时,盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液 | |
| D. | 其他条件相同时,原电池甲比原电池乙的可储存时间长 |
6.有A、B、C、D四种金属,投入水中只有D反应放出氢气,A、C用导线相连时后浸入稀硫酸中,C为正极,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
3.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:④Mg;⑫Br.
(2)画出原子的结构示意图:⑤ ;⑪
;⑪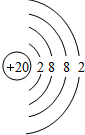 .
.
(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:⑤
 ;⑪
;⑪ .
.(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
20.能把苯、四氯化碳、己烯、丙醛四种物质区别开来的一种试剂是( )
| A. | 水 | B. | 溴水 | C. | FeCl3溶液 | D. | 银氨溶液 |
1.下列说法正确的是( )
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
 ,请回答下列问题:
,请回答下列问题: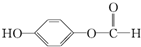 ;
;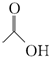 ,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为: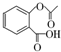 ,则阿司匹林的分子式为C9H8O4.
,则阿司匹林的分子式为C9H8O4.