题目内容
5.几种短周期元素的原子半径和主要化合价见表,下列有关说法中,正确的是( )| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| C. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| D. | 与稀盐酸反应的剧烈程度:M单质<X单质 |
分析 短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X、M均有+2价,处于ⅡA族,原子半径X>M,则X为Mg元素、M为Be;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素,结合元素周期律及物质的结构与性质解答.
解答 解:短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X、M均有+2价,处于ⅡA族,原子半径X>M,则X为Mg元素、M为Be;Y为+3价,处于ⅢA族.原子半径大于硫,所以Y为Al元素.
A.X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;
B.Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;
C.非金属性Cl>S,所以稳定性HCl>H2S,即L的氢化物的稳定性强于Z的氢化物的稳定性,故C错误;
D.金属性Mg>Be,故Mg与盐酸反应更剧烈,故D正确,
故选D.
点评 本题考查元素的性质与位置关系,利用原子半径及化合价来推断出元素是解答关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
1.下列说法正确的是( )
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
13.有关下列反应的说法中,正确的是( )
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
15.室温下,pH=13的碱溶液V1mL与pH=2的硫酸溶液V2mL混合,得混合液pH=11,则V1:V2为( )
| A. | V1:V2≥11:1 | B. | V1:V2≥9:1 | C. | V1:V2≤11:1 | D. | V1:V2≤1:9 |
 .其基态原子有26种能量不同的电子;
.其基态原子有26种能量不同的电子;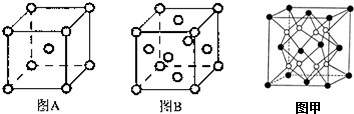
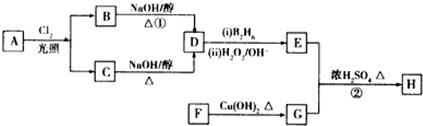
 .
. .
.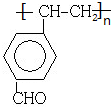 .
.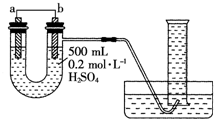 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题: