题目内容
9.钠硫电池属于温绿色二次电流,用液态钠、硫和多硫化钠作电极,以能传导钠离子的固体氧化铝作电解质.电池反应为:2Na+xS$?_{充电}^{放电}$Na2Sx.下列有关说法正确的是( )| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
分析 原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,阳离子移向正极,充电时,阳极上发生失电子的氧化反应,阴极上发生得电子得还原反应,阳离子移向阴极,根据电极反应结合电子守恒可以进行相关计算.
解答 解:A、放电时,阳离子移向正极,即Na+从负极移向正极,故A错误;
B、放电时,正极上得电子发生还原反应,电极反应式为xS+2Na++2e-=Na2Sx,故B正确;
C、充电时,阳极发生失电子的氧化反应,电极反应式为Sx2--2e-=xS,故C错误;
D、放电时,正极上得电子发生还原反应,电极反应式为xS+2Na++2e-=Na2Sx,每有0.4mol电子转移,有9.2gNa+参加反应,金属钠不会参与反应,故D错误.
故选B.
点评 本题考查了原电池和电解质的工作原理以及电极反应式的书写和离子的流向知识,考查角度广,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.将反应Zn+CuSO4═ZnSO4+Cu设计成原电池.下列判断不正确的是( )
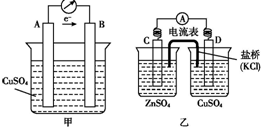

| A. | 若设计成图甲所示的原电池,电极A、B分别是Zn、Cu | |
| B. | 若设计成图乙所示的原电池,D电极反应式为:Cu2++2e-═Cu | |
| C. | 原电池乙工作时,盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液 | |
| D. | 其他条件相同时,原电池甲比原电池乙的可储存时间长 |
20.能把苯、四氯化碳、己烯、丙醛四种物质区别开来的一种试剂是( )
| A. | 水 | B. | 溴水 | C. | FeCl3溶液 | D. | 银氨溶液 |
17.接触法生产硫酸的过程中,对废气、废水、废渣、废热的处理正确的是( )
①尾气用氨水处理
②污水用石灰乳处理
③废渣用来造水泥、炼铁
④设置废热锅炉产生蒸汽、供热或发电.
①尾气用氨水处理
②污水用石灰乳处理
③废渣用来造水泥、炼铁
④设置废热锅炉产生蒸汽、供热或发电.
| A. | ①②③④ | B. | ①③④ | C. | ①②③ | D. | ①② |
14. A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
回答下列问题:
(1)基态E原子的核外M层电子云有9种不同的伸展方向,基态E原子核外价电子排布式为3d54s1,元素F属于d区.
(2)A与C形成的最简单分子的空间构型为三角锥形,中心原子的杂化方式为sp3.
(3)B,C,D第一电离能由大到小的顺序是N>O>C(用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是N2O和CO2
(4)E元素可以形成配位 数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出$\frac{1}{3}$的氯元素,该配合物可表示为[Cr(H2O)4Cl2]Cl•2H2O.
(5)元素F的一种氯化物的晶胞结构如图 所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为12;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为$\root{3}{\frac{398}{4.14{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
 A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:| A | 宇宙中含量最丰富的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最高价氧化物对应的水化物与其氢化物反应生成盐 |
| D | 原子核外电子有8种不同的运动状态 |
| E | 基态原子核外有六个未成对电子 |
| F | 原子最外层只有一个电子 |
(1)基态E原子的核外M层电子云有9种不同的伸展方向,基态E原子核外价电子排布式为3d54s1,元素F属于d区.
(2)A与C形成的最简单分子的空间构型为三角锥形,中心原子的杂化方式为sp3.
(3)B,C,D第一电离能由大到小的顺序是N>O>C(用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是N2O和CO2
(4)E元素可以形成配位 数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出$\frac{1}{3}$的氯元素,该配合物可表示为[Cr(H2O)4Cl2]Cl•2H2O.
(5)元素F的一种氯化物的晶胞结构如图 所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为12;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为$\root{3}{\frac{398}{4.14{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
1.下列说法正确的是( )
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
18.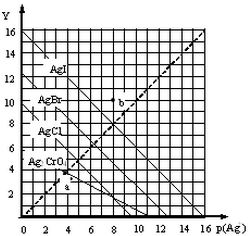 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
13.有关下列反应的说法中,正确的是( )
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |