题目内容
4.在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量变小的是( )①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
分析 醋酸钠溶液中存在水解平衡:CH3COO-+H2O?CH3COOH+OH-,CH3COONa溶液加水稀释,平衡向正反应方向移动,醋酸根离子的水解程度增大,但是溶液中c(OH-) 减小,c(H+)增大;溶液中醋酸根离子的物质的量减小,CH3COOH分子的物质的量增大,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值减小;温度不变,水的离子积不变,据此进行解答.
解答 解:①CH3COONa溶液中存在水解平衡:CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,溶液中c(OH-)减小,由于水的离子积不变,所以c(H+)增大,故①不符合;
②c(OH-),醋酸钠溶液加水稀释后,醋酸根离子水解程度增大,但溶液中氢氧根离子浓度减小,故②符合;
③醋酸钠稀释后,醋酸根离子水解程度增大,溶液中醋酸根离子的物质的量减小,醋酸分子的物质的量增大,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值减小,故③符合;
④由于温度不变,所以水的离子积不变,即c(H+)•c(OH-)的值不会变化,故⑤不符合;
故选C.
点评 本题考查了盐的水解原理及其影响因素,题目难度中等,注意掌握盐的水解原理,明确影响盐的水解的因素,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
12.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )


| A. | 元素的非金属性:Y>W | |
| B. | 阴离子的还原性:W2->Q- | |
| C. | 离子半径:Y2->Z3+ | |
| D. | Q、W、Y对应的氢化物的沸点逐渐降低 |
9.已知某酸H2B在水溶液中存在下列关系:①H2B?H++HB-,②HB-?H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A. | NaHB属于弱电解质 | |
| B. | 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-) | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H2O | |
| D. | c(Na+)=c(HB-)+c(B2-)+c(H2B) |
16.下列操作达不到预期目的是( )
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用乙醇和63%的硫酸共热到170℃制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用乙醇和63%的硫酸共热到170℃制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
| A. | 只有②③④⑤ | B. | 只有①③④⑤ | C. | ①②③④⑤ | D. | 只有①②③⑤ |
13.下列化学用语表示正确的是( )
| A. | 氧的原子结构示意图: | B. | 甲烷的比例模型: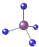 | ||
| C. | 硫化钾的电子式: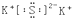 | D. | CO2的结构式:O-C-O |
6.0.1L某溶液含有0.1mol KCl和0.1mol CaCl2,此溶液中Cl-的物质的量浓度是( )
| A. | 3mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.1mol•L-1 |
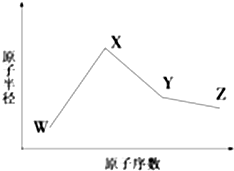 W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.
W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.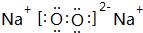 ,
,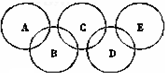 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题: ;若XY2为共价化合物时,其电子式为:
;若XY2为共价化合物时,其电子式为: .
.