题目内容
6.0.1L某溶液含有0.1mol KCl和0.1mol CaCl2,此溶液中Cl-的物质的量浓度是( )| A. | 3mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.1mol•L-1 |
分析 根据氯原子守恒得n(Cl-)=n(KCl)+2n(CaCl2)=0.1mol+2×0.1mol=0.3mol,混合溶液中c(Cl-)=$\frac{n}{V}$.
解答 解:根据氯原子守恒得n(Cl-)=n(KCl)+2n(CaCl2)=0.1mol+2×0.1mol=0.3mol,混合溶液中c(Cl-)=$\frac{n}{V}$=$\frac{0.3mol}{0.1L}$=3mol/L,故选A.
点评 本题考查物质的量浓度的有关计算,侧重考查分析计算能力,利用原子守恒解答即可,题目难度不大.

练习册系列答案
相关题目
4.在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量变小的是( )
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
5.图是元素周期表的一部分,试用化学符号回答下列问题:
(1)在这些元素中,单质的化学性质最不活泼的是Ar(填具体元素符号),其原子结构示意图为 .
.
(2)在这些元素中,③的气态氢化物与⑧的气态氢化物反应的现象为冒白烟,产物的晶体类型为离子晶体.
(3)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物的电子式为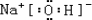 .
.
(4)⑥的单质与②、④形成的某种化合物反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)在⑦、⑧两种元素中,非金属性较强的是Cl(填具体元素符号),能证明这一结论的化学方程式为Cl2+H2S=2HCl+S.
(6)科学家借助元素周期表研究合成有特定性质的新物质,如在金属与非金属交界处寻找半导体材料.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.(2)在这些元素中,③的气态氢化物与⑧的气态氢化物反应的现象为冒白烟,产物的晶体类型为离子晶体.
(3)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物的电子式为
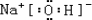 .
.(4)⑥的单质与②、④形成的某种化合物反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)在⑦、⑧两种元素中,非金属性较强的是Cl(填具体元素符号),能证明这一结论的化学方程式为Cl2+H2S=2HCl+S.
(6)科学家借助元素周期表研究合成有特定性质的新物质,如在金属与非金属交界处寻找半导体材料.
1.已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1 kJ•mol-12H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ•mol-12H2(g)+O2(g)═2H2O(l)△H=-Q3 kJ•mol-1常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况)经完全燃烧后恢复到常温,则放出的热量为( )
| A. | (0.4 Q1+0.05 Q3) kJ | B. | (0.4 Q1+0.05 Q2) kJ | ||
| C. | (0.4 Q1+0.1 Q3) kJ | D. | (0.4Q1+0.2 Q1) kJ |
18.同一周期三种非金属元素X、Y、Z,其最高价氧化物的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4.下列说法正确的是( )
| A. | 元素的非金属性:X<Y<Z | B. | X、Y、Z依次位于ⅤA族、ⅥA族、ⅦA族 | ||
| C. | 阴离子的还原性:X->Y2->Z3- | D. | 气态氢化物的稳定性:HX>H2Y>ZH3 |
16.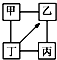 图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
 图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | H2SO4 | Na2SO4 | NaOH | NaCl |
| B | KCl | K2CO3 | KOH | HCl |
| C | O2 | CO | CuO | C |
| D | Fe | CuCl2 | Zn | HCl |
| A. | A | B. | B | C. | C | D. | D |
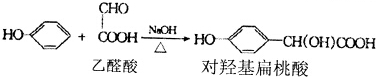
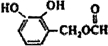 .
.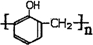 .
.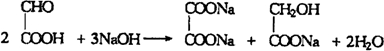 .
. 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: